
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C.充电时,蓄电池的负极应与外接电源正极相连
D.放电时负极附近溶液的碱性减弱
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
|
|
|
|
① | ② | ③ | ④ |
A.装置①表示已组装的铜锌原电池
B.装置②工作一段时间后,a极附近溶液的pH减小
C.装置③可以在铁钉上镀铜
D.装置④保护铁闸门不被腐蚀,为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.金属钠和其他碱金属都可保存在煤油中
B.湿法冶炼是指金属在溶液中发生的置换反应,如金属钠置换出硫酸铜溶液中的铜
C.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
D.制备![]() 、
、![]() 、
、![]() 均不能采用将溶液直接蒸干的方法
均不能采用将溶液直接蒸干的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为![]() 或
或![]() ]与pH的变化关系如图所示。下列说法正确的是( )
]与pH的变化关系如图所示。下列说法正确的是( )

A.Ⅱ表示lg![]() 随pH变化的关系曲线
随pH变化的关系曲线
B.pH=1.22的溶液中:c(HC2O4-)=c(C2O42-)
C.NaHC2O4溶液中:c(H+)<c(OH-)
D.pH=4.19的溶液中:c(Na+)<3c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。写出反应的离子方程式:_______________________。
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(T) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率×10-3mol·L-1·min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是________________________________________________。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________________________。
II.生活污水中的磷和氮主要以磷酸盐和铵盐形式存在。
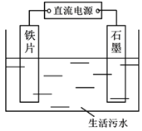
(1)除磷的原理如上图所示,利用电解法将PO43-转化为Fe3(PO4)2沉淀除去。铁作___________,(填“阴极”“阳极”),用化学用语表示产生Fe2+的主要过程:__________________________。
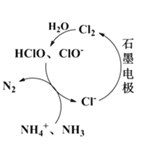
(2)有Cl-存在时,除氮原理如图所示,主要依靠电解产生的有效氯(HClO、ClO-)将NH4+或NH3氧化为N2.当pH<7时,主要发生HClO氧化NH4+的反应,其离子方程式为:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )
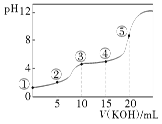
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向体积相同、浓度均为0.1 mol/L的MOH、ROH两种碱溶液中不断加水稀释,溶液的pH与溶液浓度的对数(lgc)间的关系如图。下列说法错误的是

A. Kb(MOH)的数量级为10-5
B. a、b两点溶液中,水的电离程度:a<b
C. 等体积等浓度的ROH和MCl混合后所得溶液中:c(OH-)>c(H+)
D. 用相同浓度的盐酸分别中和a、b两点溶液,消耗盐酸体积:Va>Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A.CO与HbO2反应的平衡常数K=![]()
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案设计能达到实验目的的是
A | B | C | D |
检验淀粉是否水解 | 由褪色快慢研究反应物浓度对反应速率的影响 | 证明发生了取代反应 | 验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ] |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com