
【题目】SO2在工业生产和食品加工等行业用途广泛。某化学小组对SO2的一些性质和反应进行探究。回答下列问题:
I.为探究SO2和Na2O2的反应产物,进行如下实验。
(1)提出假设。假设一:反应产物为Na2SO3和O2;假设二:反应产物为___(填化学式)。
(2)实验验证。
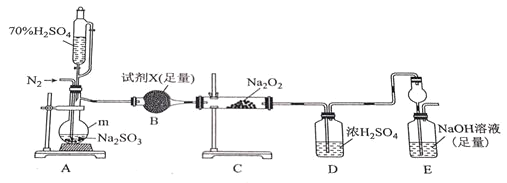
①m的名称为___。
②A中若用稀硫酸代替70%的硫酸,不足之处为___。
③试剂X不宜选择___(填选项字母)。
a.生石灰 b.CaCl2 c.硅胶 d.P2O5
④B的作用___。
II.SO2可以用作葡萄酒的抗氧化剂和防腐剂。该小组同学通过下列操作测定某葡萄酒样品SO2的总含量:量取V1mL样品,加入足量稀H2SO4;将生成的SO2全部蒸出并用足量NaOH溶液吸收;调节溶液的pH后,用cmol/L的标准I2溶液滴定至终点,消耗标准液的体积为V2mL。
(3)滴定反应的离子方程式为___;样品中的总含量为___mg/L(用含c,V1,V2的代数式表示)。
(4)若用足量稀盐酸代替稀H2SO4,会导致所测SO2的总含量___(填偏高偏低或无影响)。
III.(5)设计实验证明H2SO3的酸性强于H2CO3:___。(供选试剂:NaHCO3溶液、CO2、SO2、KMnO4(H+)溶液、NaOH溶液、澄清石灰水)
【答案】Na2SO4 蒸馏烧瓶 导致SO2溶解损失,降低反应速率 a 干燥SO2气体 SO32-+I2+H2O=SO42-+2I-+2H+ ![]() 无影响 将SO2先通入NaHCO3溶液,再将所得气体通过足量KMnO4(H+)溶液除去SO2,最后将气体通入澄清石灰水中,澄清石灰水变浑浊,证明H2SO3的酸性强于H2CO3
无影响 将SO2先通入NaHCO3溶液,再将所得气体通过足量KMnO4(H+)溶液除去SO2,最后将气体通入澄清石灰水中,澄清石灰水变浑浊,证明H2SO3的酸性强于H2CO3
【解析】
(1)利用Na2O2具有强氧化性,SO2具有还原性,进行分析;
(2)①根据仪器特点,得出仪器的名称;
②利用SO2易溶于水,浓度对反应速率的影响;
③装置A中气体为SO2,利用SO2为酸性氧化物,进行分析;
④因为Na2O2能与水反应,因此装置B的作用是干燥SO2;
(3)SO2被NaOH吸收,得到Na2SO3,利用I2的氧化性将SO32-氧化成SO42-,书写出氧化还原反应;根据反应方程式,求出结果;
(4)盐酸具有挥发性,蒸出的SO2中混有HCl,干扰实验;
(5)利用酸性强的制取酸性弱的。
(1)过氧化钠具有强氧化性,二氧化硫具有还原性,据此可知,反应产物还可能是![]() ,故答案为:
,故答案为:![]() ;
;
(2)![]() 的名称为蒸馏烧瓶,故答案为:蒸馏烧瓶;
的名称为蒸馏烧瓶,故答案为:蒸馏烧瓶;
![]() 二氧化硫能溶于水,使用稀硫酸,会导致
二氧化硫能溶于水,使用稀硫酸,会导致![]() 溶解而损失,同时反应物浓度减小,化学反应速率减缓,
溶解而损失,同时反应物浓度减小,化学反应速率减缓,
故答案为:导致![]() 溶解损失,降低反应速率
溶解损失,降低反应速率![]() 答出一点即可
答出一点即可![]() ;
;
![]() 试剂X的作用是干燥二氧化硫,二氧化硫能与碱或碱性氧化物反应,不能使用氧化钙干燥,故a符合题意,
试剂X的作用是干燥二氧化硫,二氧化硫能与碱或碱性氧化物反应,不能使用氧化钙干燥,故a符合题意,
故答案为:a;
![]() 的作用是干燥
的作用是干燥![]() 气体,故答案为:干燥
气体,故答案为:干燥![]() 气体;
气体;
(3)二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠能被碘单质氧化为硫酸钠,则滴定反应的离子方程式为![]() ;滴定过程中消耗的碘单质的物质的量为
;滴定过程中消耗的碘单质的物质的量为![]() ,由离子反应方程式可知,溶液中的
,由离子反应方程式可知,溶液中的![]() ,由S元素的守恒可知样品中
,由S元素的守恒可知样品中![]() 的物质的量为
的物质的量为![]() ,则样品中的
,则样品中的![]() 总含量为
总含量为![]() =
=![]() ;
;
故答案为:![]() ;
;![]() ;
;
(4)盐酸的酸性强于亚硫酸,故使用稀盐酸代替稀硫酸不影响二氧化硫的生成,且挥发出来的氯化氢也不与碘单质反应,故使用稀盐酸代替稀硫酸对所测![]() 的总含量不影响,
的总含量不影响,
故答案为:不影响;
(5)利用强酸制弱酸的原理可证明不同酸的酸性强弱,证明![]() 的酸性强于
的酸性强于![]() 具体实验为将
具体实验为将![]() 先通入
先通入![]() 溶液,再将所得气体通过足量
溶液,再将所得气体通过足量![]() 溶液除去
溶液除去![]() ,最后将气体通入澄清石灰水中,澄清石灰水变浑浊,证明
,最后将气体通入澄清石灰水中,澄清石灰水变浑浊,证明![]() 的酸性强于
的酸性强于![]() 。
。
故答案为:将![]() 先通入
先通入![]() 溶液,再将所得气体通过足量
溶液,再将所得气体通过足量![]() 溶液除去
溶液除去![]() ,最后将气体通入澄清石灰水中,澄清石灰水变浑浊,证明
,最后将气体通入澄清石灰水中,澄清石灰水变浑浊,证明![]() 的酸性强于
的酸性强于![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) ![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.探究“硫代硫酸钠与酸反应速率的影响因素”的实验中,通过观察产生气体的快慢,来反映试剂反应速率的大小,从而探究浓度温度等外界条件对该反应的化学反应速率的影响
B.容量瓶、滴定管上都标有使用温度和“0”刻度;使用前水洗后滴定管还需润洗,而容量瓶不需要润洗
C.油脂皂化反应后的反应液中加入饱和食盐水并搅拌后出现分层,则生成的高级脂肪酸钠在下层
D.只用![]() 溶液就可鉴别出稀盐酸、NaOH溶液、
溶液就可鉴别出稀盐酸、NaOH溶液、![]() 溶液、
溶液、![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
请回答下列问题:(电子式和化学方程式书写每空2分,其余每空1分)
(1)写出A的电子式 ,B、D分子中的官能团名称分别是 、 。
(2)写出下列反应的化学方程式,并注明反应类型:
① , ;
② , ;
④ , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )

A.在NaCl晶体中,距Na+最近的Cl-有6个
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,最小的环上有6个C原子
D.该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乳酸薄荷醇酯 ![]() 仅能发生水解、氧化、消去反应
仅能发生水解、氧化、消去反应
B.乙醛和丙烯醛![]() 不是同系物,但它们与氢气充分反应后的产物是同系物
不是同系物,但它们与氢气充分反应后的产物是同系物
C.甲醇、乙醇、乙二醇的沸点逐渐升高
D.甲苯、乙烯均能使酸性 KMnO4 溶液褪色,但反应原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B元素的名称 、 。
(2)B位于元素周期表中第 周期第 族。
(3)C的原子结构示意图为 。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻技术需利用深紫外激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟硼铍酸钾(KBeBF,含K、B、Be、O、F元素)。
回答下列问题:
(1)一群均处于激发态1s22s13s1的铍原子,若都回到基态,最多可发出___种波长不同的光。
A.1 B.2 C.3 D.4
(2)Be和B都容易与配体形成配位键,如[BeF4]-、[B(OH)4]-等,从原子结构分析其原因是__。
(3)氟硼酸钾是制备KBeBF的原料之一,高温下分解为KF和BF3。KF的沸点比BF3的高,原因是___。
(4)BF3易水解得到H3BO3(硼酸)和氢氟酸。氢氟酸浓溶液中因F-与HF结合形成HF![]() 使酸性大大增强。HF
使酸性大大增强。HF![]() 的结构式为___;H3BO3和BF
的结构式为___;H3BO3和BF![]() 中,B原子的杂化类型分别为___、__。
中,B原子的杂化类型分别为___、__。
(5)KBeBF晶体为层片状结构,图1为其中一层的局部示意图。平面六元环以B—O键和Be—O键交织相连,形成平面网状结构,每个Be都连接一个F,且F分别指向平面的上方或下方,K+分布在层间。KBeBF晶体的化学式为____。

(6)BeO晶体也是制备KBeBF的原料,图2为其晶胞结构示意图。
①沿着晶胞体对角线方向的投影,下列图中能正确描述投影结果的是___。

②BeO晶胞中,O的堆积方式为____;设O与Be的最近距离为acm,NA表示阿伏加德罗常数的值,则BeO晶体的密度为____g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com