
【题目】污水处理的主要方法有:①中和法;②化学沉淀法;③氧化还原法;④过滤法。其中属于化学方法的有( )。
A. ①②③ B. ①②④
C. ②③④ D. ①②③④
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】 酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
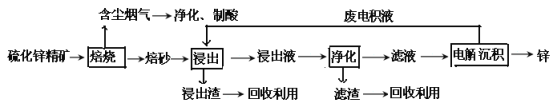
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体_。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为___________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等
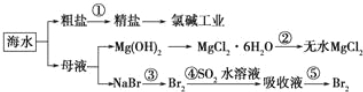
A.除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl26H2O灼烧即可制得无水MgCl2
C.从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.Na2O2与H2O反应 B.灼热的木炭与水蒸气反应
C.铝热反应 D.CH4与O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V、W、X、Y、Z是五种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示:

已知Y的最高价氧化物对应的水化物可与其简单氢化物反应可生成盐;Z是地壳中含量最多的元素;W原子的最外层电子数与Ne原子的最外层电子数相差1;V为原子核内有12个中子的二价金属,当2 .4克V与足量盐酸反应时,在标准状况下放出气体2.24L;请回答下列问题:
(1)指出Y元素在周期表中的位置_________。
(2)写出W的简单离子的结构示意图_______________。
(3)比较W的气态氢化物与H2S和HF的稳定性(由强到弱)____________。(填化学式)
(4)由W、Y两种元素组成的一种化合物,每个原子最外层均达到8电子稳定结构,写出该化合物的电子式____________。
(5)由X、Y、Z三种元素组成的化合物,是一种常见的化肥,其原子个数比为4:2:3,则该物质含有的化学键类型为_____________。
(6)V与W两元素最高价氧化物的水化物反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾是一种强氧化剂,在不同条件下KClO3将KI氧化为I2或KIO3。某实验小组在实验室中对KClO3和KI的反应进行了探究。回答下列问题:
实验一 制取氯酸钾

(1)A中反应的化学方程式为_______。实验开始时,首先进行的实验步骤是________。
(2)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有_______.
(3)A和B装置之间缺少除去氯气中氯化氢的装置,是否会对实验结果产生不利影响,其理由
是_________(填“是”或“否”,若选择“是”请说明理由,若选择“否”则不需说明理由)
实验二 氯酸钾与碘化钾反应的研究
(4)该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL﹣1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL﹣1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是__.
②设计1号试管实验的作用是__.
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见食品添加剂,为检验某食品中亚硫酸盐含量,某研究小组设计了如下两种实验流程:
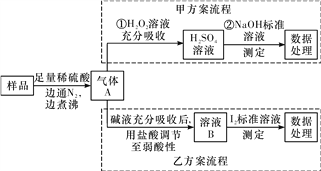
(1)气体A的主要成分是________(填化学式),加热煮沸时必须先向烧瓶中加入碎瓷片,其目的是______________________;边通入N2边煮沸的目的是________________。
(2)写出甲方案第①步反应的离子方程式:________________________。
(3)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果______(填“偏高”、“偏低”或“无影响”)。
(4)若亚硫酸盐为Na2SO3,取样品w g,按乙方案测得消耗0.0100 mol·L-1I2溶液V mL,则样品中含Na2SO3的质量分数是__________(用含w、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能证明甲酸(HCOOH,一元酸)为弱酸的是( )
A.0.1mol/L甲酸的pH为2.3
B.将pH=2的甲酸稀释100倍后,溶液的pH小于4
C.温度升高,溶液的导电能力增强
D.等体积等浓度的甲酸和HCl与足量的锌反应,产生等量的氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com