
| A. | 83% | B. | 17% | C. | 50% | D. | 60% |
分析 设转化的CO为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 2 10 0 0
转化 x x x x
平衡 2-x 10-x x x
$\frac{\frac{x}{V}×\frac{x}{V}}{\frac{(2-x)}{V}×\frac{(10-x)}{V}}$=1.0,以此来解答.
解答 解:设转化的CO为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 2 10 0 0
转化 x x x x
平衡 2-x 10-x x x
$\frac{\frac{x}{V}×\frac{x}{V}}{\frac{(2-x)}{V}×\frac{(10-x)}{V}}$=1.0,解得x=1.66mol,
则CO转化为CO2的转化率为$\frac{1.66mol}{2mol}$×100%=83%,
故选A.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意结合平衡浓度计算K,题目难度不大.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
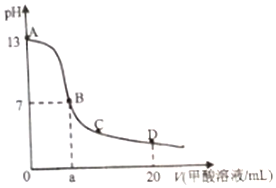 在15mL0.lmol•L-1KOH溶液中逐滴加入0.2mol•L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )
在15mL0.lmol•L-1KOH溶液中逐滴加入0.2mol•L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )| A. | 在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 | |
| B. | 在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+) | |
| C. | 在D点:c(HCOO-)+c(HCOOH)>2c(K+) | |
| D. | B→C段:水的电离程度先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
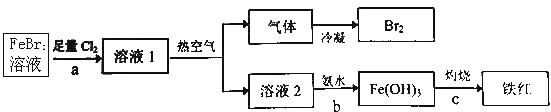
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
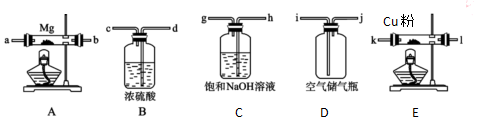
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
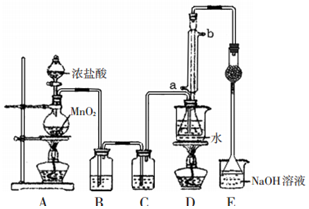 S2Cl2是工业上常用的硫化剂,实验室利用反应:CS2+3Cl2=CCl4+S2Cl2来制备S2Cl2,反应装置如图所示(部分夹持装置省略).
S2Cl2是工业上常用的硫化剂,实验室利用反应:CS2+3Cl2=CCl4+S2Cl2来制备S2Cl2,反应装置如图所示(部分夹持装置省略).| 物质 | 沸点/℃ | 熔点/℃ |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素与淀粉互为同分异构体 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物,一定条件下均能水解 | |
| C. | 煤的气化、煤的液化和石油的分馏都是化学变化 | |
| D. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com