
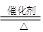 4NO + 6H2O ��������Ϊ��ԭ���������� ���ѧʽ��������Ӧ��������0.2 mol NO����ת�� mol���ӣ�
4NO + 6H2O ��������Ϊ��ԭ���������� ���ѧʽ��������Ӧ��������0.2 mol NO����ת�� mol���ӣ�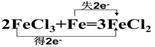 �� FeCl3
�� FeCl3 


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ϡ����ϴȥ�����Թ��ڱڵ����� |
| B�����ȵĴ�����Һ��ϴ���� |
| C�������Ƶ�������ͭ����Һ�벡�˵���Һ��ͼ��ȣ������鲡���Ƿ����� |
| D�������ʶƼ��϶�ͭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A���ѻӷ��� | B��ǿ���� | C����ˮ�� | D����ˮ�� E��ǿ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������ԭ��Ӧ�У�һ��Ԫ�ػ��ϼ�������һ������һ��Ԫ�ػ��ϼ��½� |
| B�������ᡢ���ˮ�����ֱ������ᡢ��� |
| C���Ӵ����������У�Ϊ���SO2��ת���ʣ��Ӵ����ڷ�Ӧ�¶�ѡ����400��~500�� |
| D��ij����ֻ����һ��Ԫ�أ�������ʿ���Ϊ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Fe3+��NO3�C��I�C��K+ | B��H+��NO3�C��Fe2+��Na+ |
| C��K+��Al3+��H+��MnO4�C | D��Cu2+��NH4+��Br�C��OH�C |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ǿ�����ԣ�������ɱ������ԭ����������ˮ������ |
| B����ǿ��ԭ�ԣ�������ɱ������������������ˮ������ |
| C����ǿ�����ԣ�������ˮ�����ʣ���ԭ����������ɱ�� |
| D����ǿ��ԭ�ԣ�������ˮ�����ʣ���������������ɱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com