
| A. | x的数值是2 | |
| B. | A的转化率为50% | |
| C. | B的平衡浓度为2mol/L | |
| D. | 反应前后混合气体的压强之比为22:25 |
分析 D的平均反应速率为0.1mol•L-1•min-1,生成D的物质的量为:0.1mol•L-1•min-1×5min×4L=2mol,
5A(g)+4B(g)?6C(g)+xD(g)
起始量(mol) 5 6 0 0
变化量(mol) 2.5 2 3 2
平衡量(mol) 2.5 4 3 2,
结合题给化学反应速率概念,速率之比等于化学方程式中的系数之比进行分析计算,压强之比等于物质的量之比.
解答 解:D的平均反应速率为0.1mol•L-1•min-1,生成D的物质的量为:0.1mol•L-1•min-1×5min×4L=2mol,
5A(g)+4B(g)?6C(g)+xD(g)
起始量(mol) 5 6 0 0
变化量(mol) 2.5 2 3 2
平衡量(mol) 2.5 4 3 2
A.物质的量的变化量之比等于化学方程式中的系数之比,C、D的物质的量之比为3:2,则x=4,故A错误;
B.A的转化率为:$\frac{2.5mol}{5mol}$×100%=50%,故B正确;
C.B的平衡浓度为:$\frac{4mol}{4L}$=1mol/L,故C错误;
D.反应前后混合气体的物质的量之比为:$\frac{5mol+6mol}{2.5mol+4mol+3mol+2mol}$=$\frac{22}{23}$,相同条件下压强之比等于物质的量之比=22:23,故D错误;
故选B.
点评 本题考查了化学平衡的计算应用,题目难度中等,注意反应速率概念及表达式,明确三段式在化学平衡计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 二甲苯和四甲苯均有三种 | |
| B. | 利用核磁共振氢谱可以鉴别1-丙醇和2-丙醇 | |
| C. | 溴苯水解后,滴加硝酸酸化的硝酸银溶液检验水解产物中的溴离子 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
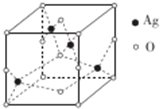 乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备:
乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备: ),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.
),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.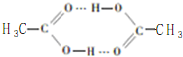
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰具有强氧化性,可作双氧水分解的氧化剂 | |
| B. | 浓硫酸具有较强酸性,常用作淀粉水解的催化剂 | |
| C. | 碳具有还原性,一定条件下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.工业上常用天然气制备合成CH3OH的原料气.
随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.工业上常用天然气制备合成CH3OH的原料气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的氧化物对应的水化物一种是强酸 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性的透明溶液中:K+、SO42-、NO3-、Fe3+ | |
| B. | 在KMnO4溶液中:SO42-、Mg2+、NO3-、CH3CH2OH | |
| C. | 常温下由水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、NH4+、Cl-、SiO32- | |
| D. | 离子物质的量浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它的一氯代物有9种(不考虑立体异构) | |
| B. | 它的分子中最多有7个原子共平面 | |
| C. | 一定条件下,它分别可以发生加成、取代、氧化、还原反应 | |
| D. | 它和丁基苯(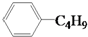 )互为同分异构体 )互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
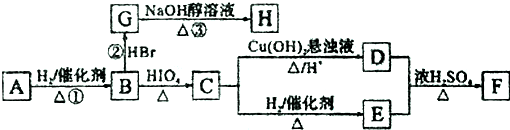
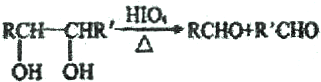 .
. ,若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
,若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com