
| A. | 简单离子半径:Y>Q | |
| B. | Q分别与X、Z形成的最简单化合物中化学键类型相同 | |
| C. | YW能与WQ发生复分解反应 | |
| D. | 最简单气态氢化物的稳定性:X<Z |
分析 W、X、Y、Z、Q是五种常见的短周期主族元素,原子序数依次增大,在周期表中W原子半径最小,则W为H元素;X元素原子核外电子总数是其次外层电子数的3倍,所以X是C元素;W和Y、X和Z均位于同一主族,则Z为Si元素,Y的原子序数大于X,则Y为Na元素;Q的非金属性在同周期元素中最强,Q的原子序数大于Na和Si,则Q为Cl元素,据此结合元素周期律知识进行解答.
解答 解:在周期表中W原子半径最小,则W为H元素;X元素原子核外电子总数是其次外层电子数的3倍,所以X是C元素;W和Y、X和Z均位于同一主族,则Z为Si元素,Y的原子序数大于X,则Y为Na元素;Q的非金属性在同周期元素中最强,Q的原子序数大于Na和Si,则Q为Cl元素,
A.Y为Na,Q为Cl,电子层越多,离子半径越大,则离子半径Y<Q,故A错误;
B.Q分别与X、Z形成的最简单化合物分别为四氯化碳、四氯化硅,四氯化碳和四氯化硅中含有的化学键为共价键,共价键的类型相同,故B正确;
C.YW为NaH,WQ为HCl,二者发生氧化还原反应生成氢气,不属于复分解反应,故C错误;
D.X为C,Z为Si,非金属性C>Si,则简单氢化物的稳定性:X>Z,故D错误;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,正确推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
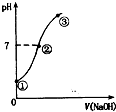 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HCl0的电离平衡 | |
| B. | ②到③的过程中水的电离程度一定减少 | |
| C. | ②点处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ②点所示溶液中:c( Na+)=c(HCl0)+2c(ClO -) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH的电离程度变大 | B. | c(CH3COO-)增大 | ||
| C. | CH3COOH的Ka不变 | D. | 溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②⑤⑥ | C. | ③④ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
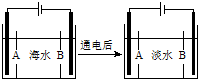 海南某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验.
海南某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
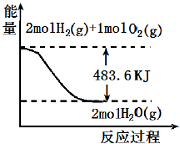
| A. | 表示 2molH2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量 | |
| B. | 表示的热化学方程式为:H2(g)+$\frac{1}{2}$02(g)═H20(g)△H=-241.8 kJ/mol | |
| C. | 表示2mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ | |
| D. | H20(g)的能量低于H2(g)和O2(g)的能量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下焦炭还原二氧化硅制得粗硅 | |
| B. | 可用Na从TiCl4的水溶液中生产Ti | |
| C. | 可用CO高温下还原赤铁矿炼铁 | |
| D. | 可用石英、石灰石、纯碱在高温下生产玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液,pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | a mol/L HCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c( Na+)>c(CN-),则a 一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 将少量的H2S通入NaCN溶液中,反应为:H2S+2CN-=2HCN+S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com