
【题目】下表是元素周期表的一部分,针对表中的①~⑦种元素,根据题意回答以下问题:

(1)在③~⑦五种元素中,原子半径最大的是____________(填元素符号);
(2)②的原子结构示意图为__________;
(3)①~⑦对应元素中最高价氧化物对应的水化物酸性最强的是________(填化学式,下同),呈两性的是________。
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
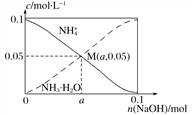
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于正丁烷(b)、2-甲基丙烷(d)、甲苯(p)的说法中正确的是
A. b与d互为同系物
B. b、d、p的一氯代物种数分别为2、3、4
C. b、d、p均不能使酸性高锰酸钾溶液褪色
D. b、d、p中只有d的所有碳原子不能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为:____________;与M同一周期的主族元素中原子半径最小的是(填元素符号)________。
(2)含有元素M的化合物Q是淡黄色固体,写出Q的电子式:______________。
(3)氧化铝溶液与过量氨水反应的离子方程式为____________________________________________;
生成物NH4Cl中存在的化学键类型为_____________________________。
(4)元素X、Y在周期表中位于同一主族,化合物Cu2X和Cu2Y可发生如下转化(其中D是纤维素水解的最终产物):
Cu2X![]() 澄清溶液
澄清溶液![]() 悬浊液
悬浊液![]() Cu2Y(砖红色沉淀)
Cu2Y(砖红色沉淀)
①D的分子式是_____________。
②Cu2Y与过量浓HNO3反应有红棕色气体生成,该反应的化学方程式为:_______________________。
③硒(Se)是人体必需的微量元素,与元素Y同一主族,Se原子比Y原子多两个电子层,则Se的原子序数为_________,其最高价氧化物对应的水化物化学式为_____________________。
该族25周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+99.7 kJ mol-1 b.+29.7 J mol-1 c.-20.6 J mol-1 d.-241.8 J mol-1
表示生成1 mol硒化氢反应热的是___________(填字母代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据如图回答下列问题:

(1)写出D的结构简式:__________。
(2)②的反应类型是__________。
(3)写出④的化学反应方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为
2NH3+3CuO![]() N2+3Cu+3H2O,试回答:
N2+3Cu+3H2O,试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的试验方案。
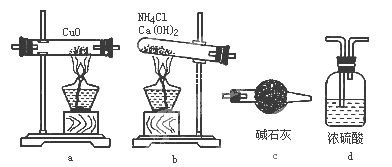
① 仪器连接的顺序(用字母编号表示,仪器可重复使用 )__________;d中浓硫酸的作用是___________,___________________;实验完毕时观察到a中的现象是_____________________;
②列出计算Cu的相对原子质量的表达式__________________;
③下列情况将使测定结果偏大的是_____________。(以下选择填空不限1个正确答案,均用字母标号填写)
A.CuO未全部还原为Cu B.CuO受潮 C.CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有___________。
A.m (Cu)和m(CuO) B. m (N2)和m (H2O)
C.m (Cu)和m(H2O) D.m(NH3)和m (H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量铁粉投入一定浓度的氯化铁和氯化铜的混合溶液中,充分反应后,溶液中剩余固体的质量与加人铁粉的质量相同,则原溶液中氯化铁和氯化铜的浓度之比为
A.2:7 B.3;4 C.4:7 D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】r—Fe2O3是一种具有磁性、催化、气敏的纳米材料。一种以硫铁矿烧渣等为原料制备r—Fe2O3的流程如下:

(1)下列有关“还原焙烧”工序的说法正确的是_____(填字母)。
a.焦炭应少量,空气应过量
b. 焙烧过程均为吸热反应,需用电炉持续加热反应器
c.“还原焙烧”的主要反应为 3C+2O2![]() 2CO+CO2、Fe2O3+CO
2CO+CO2、Fe2O3+CO![]() 2FeO+CO2
2FeO+CO2
(2)“浸取”前需将焙烧生成的熔体粉碎,其目的是_____________________。
(3)已知三种金属离子开始沉淀和完全沉淀的pH如下表:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀的pH | 2.2 | 7.5 | 4.1 |
完全沉淀的pH | 3.5 | 9.5 | 5.4 |
则“调pH”时,溶液的pH范围为_______________。
(4)滤渣1的主要成分为_________(填化学式);“沉铁”时发生反应的离子方程式为___________。
(5)“过滤2”时需用蒸馏水洗涤,能证明沉淀已洗涤干净的方法是_________;沉淀缓慢氧化为铁黄的化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com