
| A、铊元素的原子半径大于铝元素的原子半径 |
| B、铊单质的固体硬度较小 |
| C、铊的最高氧化物对应的水化物为Tl(OH)3 |
| D、铊及其化合物都没有毒性 |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| A、在Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、在pH=8的NaB溶液中:c(Na+)-c(B-)=0.99×10-6 mol?L-1 |
| C、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中:c(NH4+)大小顺序①=②>③ |
| D、向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:

 | 相对分子质量 | 密度/g?cm-3[来源:.Com] | 沸点 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.982 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
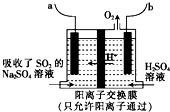 下表列出了两种燃煤烟气脱硫方法的原理.
下表列出了两种燃煤烟气脱硫方法的原理.| 方法Ⅰ | 将SO2与I2反应制H2SO4和HI,同时分解HI制H2和I2,I2循环使用 |
| 方法Ⅱ | 用Na2SO4溶液吸收SO2,再用离子膜电解法电解吸收液得到单质硫 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有一种元素是硫元素 |
| B、有一种元素是金属元素 |
| C、由这三种元素可能组成一种盐 |
| D、这三种元素分别位于不同周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4mol/L |
| B、0.6mol/L |
| C、0.8mol/L |
| D、1.0mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 点燃 |
| 溶于水 |
| 惰性电极电解 |
| A | B | C | D | |
| X | Na | Na | Al | Cu |
| Y | O2 | Cl2 | Cl2 | Cl2 |
| Z | Na2O | NaCl | AlCl3 | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com