
计算(18分)
(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比
是 ,原子数之比是 ,质量之比是 ,密度之比是
(2)下列所给出的几组物质中:含有分子数最多的是 ;含有原子数最多的
是 ;标准状况下体积最大的是 。
① 1gH2; ② 2.408×1023个CH4;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在
标准状况下的体积是 (用含NA的式子表示)。
(4)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的
浓H2SO4(密度为1.84g/cm3)的体积为 。
(1)1∶1; 2∶3; 2∶3; 2∶3; (2)③;②;①;
(3)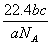 ; (4)5.4
; (4)5.4
解析试题分析:(1)同温同压下的两个相同容器,说明V和Vm相同,根据n=V/Vm可知,n相同,故分子数之比是1:1;1molO2含有2mol的氧原子,1molO3含有3mol的氧原子,故当分子数相同时,原子数之比为2:3;质量=物质的量×相对分子质量,而物质的量相同,故质量之比等于相对分子质量,即为32:48=2:3;密度等于质量除以体积,体积相同的情况下,密度之比等于质量之比,故为2:3.
(2)、1gH2有0.5molH2,1molH,2.408×1023个CH4有0.4molCH4,有0.4molC和1.6mol的H,10.8gH2O有0.6mol的H2O,1.2mol的H和0.6mol的O,标准状况下6.72LCO2有0.3molCO2,0.3mol的C和0.6mol的O,故含有分子数最多的是0.6mol的H2O,即为③;含原子数最多的是②;标准状态下,V(气)=Vm×n,Vm相同,故n大则V大,故①>②>④,又因为H2O在标准状态下为液体,其体积不适合上述公式,只能用
V=m/p=0.6mol×18(g/mol)/(1g/cm3)=10.8cm3,而 1gH2在标准状态下的体积为
0.5mol×22.4l/mol=11.2L,综上,体积最大的是①。
(3)ag某气体含有的分子数是b,即其物质的量为(b/NA),气体的相对分子质量为a/(b/NA)=(aNA)/b,故cg该气体的物质的量为c/{(aNA)/b}=bc/aNA,故标况下,其体积为22.4bc/aNA
(4)100 mL 1mol/L的的稀H2SO4溶液中H2SO4的物质的量为0.1mol,质量为9.8g,即需要质量分数为98%的H2SO4的质量为10g,又因为密度为1.84g/cm3,所以,所需的体积为10÷1.84=5.4ml
考点:物质的量
点评:此题重点考核了物质的量以及以物质的量为桥梁,计算气体体积、质量,学生要熟悉牢记公式且灵活运用,难度不大。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2015届重庆第十八中学高一上学期第一次月考化学试卷(解析版) 题型:填空题
计算(18分)
(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比
是 ,原子数之比是 ,质量之比是 ,密度之比是
(2)下列所给出的几组物质中:含有分子数最多的是 ;含有原子数最多的
是 ;标准状况下体积最大的是 。
① 1gH2; ② 2.408×1023个CH4;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在
标准状况下的体积是 (用含NA的式子表示)。
(4)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的
浓H2SO4(密度为1.84g/cm3)的体积为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com