
分析 (1)AsH3是一种很强的还原剂,与氧气反应生成As2O3与水;
(2)由题给信息可知,白磷(P4)与HClO3的水溶液反应生成H3PO4和HCl;
(3)酸性条件下,过氧化氢和铜反应生成水和铜离子;
(4)反应中Cu2S中Cu元素化合价由+1价升高为+2价、S元素化合价由-2升高为+6,总共升高10价,N元素化合价由+5价降低为NO中+2价,共降低3价,化合价最小公倍数为30,故Cu2S的系数为3,NO的系数为10,再利用原子守恒配平.
解答 解:(1)AsH3与氧气反应生成As2O3和水,反应的方程式为2AsH3+3O2=As2O3+3H2O,
故答案为:2AsH3+3O2=As2O3+3H2O;
(2)由题给信息可知白磷与HClO3的水溶液反应生成H3PO4和HCl,反应的方程式为3P4+10HClO3+18H2O=10HCl+12H3PO4,
故答案为:3P4+10HClO3+18H2O=10HCl+12H3PO4;
(3)酸性条件下Cu与过氧化氢发生氧化还原反应生成硫酸铜和水,反应的离子反应为:H2O2+Cu+2H+=Cu2++2H2O,
故答案为:H2O2+Cu+2H+=Cu2++2H2O;
(4)反应中Cu2S中Cu元素化合价由+1价升高为+2价、S元素化合价由-2升高为+6,总共升高10价,N元素化合价由+5价降低为NO中+2价,共降低3价,化合价最小公倍数为30,故Cu2S的系数为3,NO的系数为10,再利用原子守恒配平方程式为:3Cu2S+22HNO3=6 Cu(NO3)2+10NO↑+3H2SO4+8H2O,
故答案为:3;22;6;10;3;8.
点评 本题考查化学方程式书写、氧化还原反应方程式配平等,掌握方程式配平常用方法,题目难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
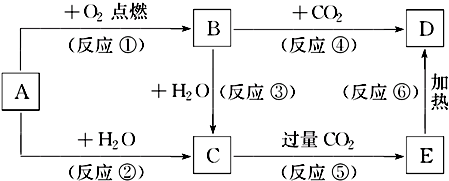
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| NaCl | AlCl3 | SiCl4 | 碳化铝 | |
| 熔点 | 810℃ | 190℃ | -68℃ | 2200℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
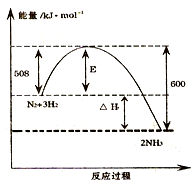 如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答: 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com