
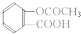

分析 (1)①钢是铁与碳的合金;铁锈蚀主要发生的是电化学腐蚀,其负极发生氧化反应铁失去电子生成二价铁离子;无机非金属材料是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料.常见的有玻璃、水泥、陶瓷等;
②依据真丝织品成分为蛋白质,化纤织品是不添加纯天然纤维材料,纯粹由涤纶、锦纶、氨纶、丙纶、维纶、腈纶、粘胶、尼龙、醋酸纤维、天丝等材料中的一种或几种合成的布料制成的衣物,依据其性质判断解答;
(2)①含钾、钠、钙、镁等矿物质较多的食物,在体内的最终的代谢产物常呈碱性,产生碱性物质的称为碱性食品,蔬菜、水果、乳类、大豆和菌类食物等;加碘盐中添加的为碘酸钾;二价铁离子若变质则被氧化生成三价铁离子,三价铁离子遇到硫氰酸钾显血红色;
②氢氧化铝能够与盐酸反应消耗氢离子;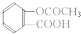 含有羧基和酯基;
含有羧基和酯基;
(3)①CO与NO在催化剂作用下生成氮气和二氧化碳;
②漂白粉与空气接触后,会和二氧化碳水反应生成碳酸钙和次氯酸,次氯酸具有强氧化性,能进行杀菌消毒漂白;
③选用能够降解的塑料袋,为了防止不能降解而带来的环境污染;把垃圾分为可回收物和不可回收物.
解答 解:(1)①钢是铁与碳的合金;
铁锈蚀主要发生的是电化学腐蚀,其负极发生氧化反应铁失去电子生成二价铁离子,电极反应式为:Fe-2e-=Fe2+;
常见的有玻璃、水泥、陶瓷等;
故答案为:铁合金;Fe-2e-=Fe2+;陶瓷;
②A.真丝织品主要成分为蛋白质,主要含有C,H,O,N四种元素,故A正确;
B.真丝制品含有蛋白质灼烧产生烧焦羽毛的气味,化纤织品不具有此性质,故B正确;
C.真丝织品中成分遇到重金属盐,强酸,强碱,有机物等会产生沉淀而失去活性,化纤织品不含蛋白质不具有此性质,故C错误;
D.两种产品都属于高分子材料,故D正确;
故选:C;
(2)①水果为碱性食物;加碘盐是指在食盐中加适量的碘酸钾;二价铁离子若变质则被氧化生成三价铁离子,三价铁离子遇到硫氰酸钾显血红色,所以检验亚铁丸是否变质方法:刮去药片上的糖衣,把药片碾碎,放入烧杯中,溶解,过滤后向滤液中加入硫氰酸钾,如果溶液变红色,说明已经变质,如果溶液没变红色说明没变质;
故答案为:水果;碘酸钾;刮去药片上的糖衣,把药片碾碎,放入烧杯中,溶解,过滤后向滤液中加入硫氰酸钾,如果溶液变红色,说明已经变质,如果溶液没变红色说明没变质;
②氢氧化铝能够与盐酸反应消耗氢离子,所以可以用来治疗胃酸过多;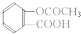 含有羧基和酯基;
含有羧基和酯基;
故答案为:胃酸过多;羧基;
(3)①CO与NO在催化剂作用下生成氮气和二氧化碳,方程式:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
②碳酸酸性强于次氯酸,漂白粉与空气接触后,会和二氧化碳水反应生成碳酸钙和次氯酸,次氯酸具有强氧化性,能进行杀菌消毒漂白,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
③塑料不易降解,影响环境的美观,所含成分有潜在危害,塑料用做包装材料多为白色,往往称为白色污染;可回收物可以重复利用,所以循环图标,
故答案为:白色污染;可回收物.
点评 本题为综合题,考查课生活中常见的化学知识,设计环境污染与治理、生活中常见的材料类型及性质、食品与药物等,题目难度不大,注意对相关知识的积累.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H2和10g O2 | B. | 标准状况下相同体积的N2和H2 | ||
| C. | 9g水和0.25mol H2 | D. | 22g CO2和3.01×1023个N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com