
【题目】下列物质的俗名与化学式对应正确的是( )
A. 食盐——NaCl B. 铁红——Fe3O4
C. 明矾——Al2(SO4)3 D. 烧碱——Ca(OH)2
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】某有机高分子合成材料K的合成路线如下图(部分反应条件和产物略去)所示。

请回答下列问题:
已知:

(1)A是相对分子质量为92的芳香烃,则A的分子式为_____________,G→H的反应类型为__________________。
(2)检验E中含氧官能团的试剂为_________________(填名称)。
(3)符合下列条件的有机物F的同分异构体有________种(不考虑顺反异构);其中核磁共振氢谱中有5组峰,且峰面积之比为3:2:2:2:1的是_________________(写结构简式)。
①遇FeCl3溶液显紫色;
②能与溴水发生加成反应;
③属于芳香化合物。
(4)写出F和J反应生成K的化学方程式__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现今太阳能光伏产业蓬勃发展,推动了高纯硅的生产与应用。回答下列问题:
Ⅰ.工业上用“西门子法”以硅石(SiO2)为原料制备冶金级高纯硅的工艺流程如下图所示:

己知:SiHCl3 室温下为易挥发、易水解的无色液体。
(1)“还原”过程需要在高温条件下,该反应的主要还原产物为_____________。
(2)“氧化”过程反应温度为200~300℃,该反应的化学方程式为__________。
(3)“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下,原因是_________________。
(4)上述生产工艺中可循环使用的物质是_________、________(填化学式)。
Ⅱ.冶金级高纯硅中常含有微量的杂质元素,比如铁、硼等,需对其进行测定并除杂,以进一步提高硅的纯度。
(5)测定冶金级高纯硅中铁元素含量
将m g 样品用氢氟酸和硝酸溶解处理,配成V mL 溶液,用羟胺(NH2OH,难电离)将Fe3+还原为Fe2+后,加入二氮杂菲,形成红色物质。利用吸光度法测得吸光度A 为0.500(吸光度A与Fe2+浓度对应曲线如图)。

① 酸性条件下,羟胺将Fe3+还原为Fe2+,同时产生一种无污染气体,该反应的离子方程式为__________________________________。
② 样品中铁元素的质量分数表达式为____________________(用字母表示)。
(6)利用氧化挥发法除冶金级高纯硅中的硼元素
采用Ar等离子焰,分别加入O2或CO2,研究硼元素的去除率和硅元素的损失率,实验结果如下图所示。在实际生产过程,应调节O2或CO2的合理比例的原因是________________。
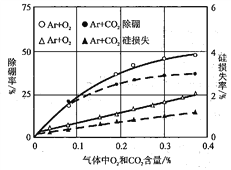
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、铁、镁、铝各取0.1mol分别投入含有0.05molHCl的盐酸溶液中,生成气体的体积在相同条件下
A. 钠最多 B. 一样多 C. 铁最多 D. 铝最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是( )
①C(s)+O2(g)=CO2(g) △H1 C(s)+1/2O2(g)=CO (g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+ ![]() O2(g)=H2O(l) △H1 2H2(g)+ O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+ O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A. ②③④ B. ① C. ④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH2=CH-COOCH3是重要的有机合成中间体,可以通过下列反应合成
CH2=CH-COOH+CH3OH![]() CH2=CH-COOCH3+H2O
CH2=CH-COOCH3+H2O
下列说法错误的是( )
A. 该有机合成反应属于取代反应
B. CH2=CH-COOCH3分子中处于同一平面的原子最少有3个
C. CH2=CH-COOH没有官能团相同的同分异构体
D. CH2=CH-COOCH3可以发生加成、氧化、取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·xH2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解,草酸钙难溶于水。某研究性小组按照下图装置,检验草酸晶体的分解产物中含有CO、CO2。已知C、E、H中盛装澄清石灰水,D中盛装浓NaOH溶液,G中盛有CuO。

(1)装置B的主要作用是_______。
(2)装置C中反应的离子方程式为_______。
(3)装置D的作用是_______。
(4)装置F所盛的药品是_______。
(5)能证明草酸晶体分解产物中有CO的现象是_______。
(6)H后连接的尾气处理装置为_______。(从“Ⅰ”“Ⅱ”中选择)
(7)为测定草酸晶体分子式(H2C2O4·xH2O) 中x的值,现做如下实验。
①称取6.3 g草酸晶体,将其配置成100.0 mL水溶液为待测溶液;
②取25.0 mL待测溶液放入锥形瓶中,再加入适量的稀硫酸;
③用浓度为0.4 mol/L的KMnO4标准溶液进行滴定,达到滴定终点时,用去12.50 mL KMnO4溶液。
回答下列问题。
写出H2C2O4和酸性KMnO4溶液反应的化学方程式_______;经计算x=_______。
(8)依据以上实验,写出草酸晶体(H2C2O4·xH2O)受热分解的化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com