
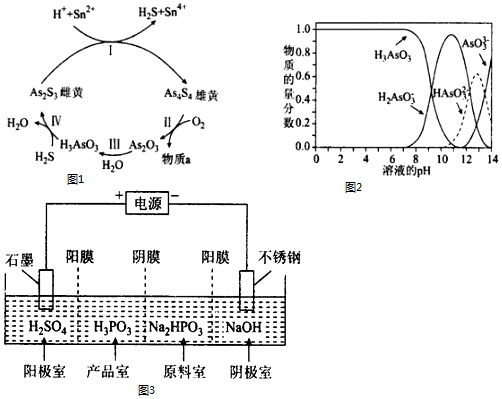
分析 (1)①Ⅰ中Sn的化合价升高,As的化合价降低;
②Ⅱ中,若1molAs4S4反应转移28mole-,则反应消耗7mol氧气,根据原子守恒书写;
(2)①根据图象结合pH分析;
②a.n(H3AsO3):n(H2AsO3-)=1:1时,溶液的pH=9;
b.pH=12时,溶液显碱性;
c.在K3AsO3溶液中,存在三步水解,以第一步水解为主;
③将KOH 溶液滴入亚砷酸溶液,当pH 调至11时,亚砷酸与氢氧根离子反应生成H2AsO3-;
(3)①亚磷酸(H3PO3),该酸与足量的NaOH溶液反应生成 Na2HPO3,说明盐为正盐,亚磷酸为弱酸,则 Na2HPO3为强碱弱酸盐;
②阴极上得电子发生还原反应,电极反应式为2H++2e-=H2↑;产品室中HPO32-和氢离子结合生成亚磷酸.
解答 解:(1)①Ⅰ中Sn的化合价升高,As的化合价降低,所以As2S3在反应中得电子作氧化剂;
故答案为:As2S3;
②Ⅱ中,若1molAs4S4反应转移28mole-,则反应消耗7mol氧气,则反应的方程式为:As4S4+7O2$\frac{\underline{\;一定条件下\;}}{\;}$2As2O3+4SO2;
故答案为:As4S4+7O2$\frac{\underline{\;一定条件下\;}}{\;}$2As2O3+4SO2;
(2)①由图象可知,pH在7.35-7.45之间,溶液中含砷元素的主要微粒是H3AsO3;
故答案为:H3AsO3;
②a.n(H3AsO3):n(H2AsO3-)=1:1时,溶液的pH=9,所以溶液显碱性,故a正确;
b.pH=12时,溶液显碱性,则c(OH-)>c(H+),所以c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)>c(H+),故b错误;
c.在K3AsO3溶液中,存在三步水解,以第一步水解为主,第一步水解生成HAsO32-,第二步水解生成H2AsO3-,则c(AsO33-)>c(HAsO32-)>c(H2AsO3-),故c正确;
故答案为:b;
③将KOH 溶液滴入亚砷酸溶液,当pH 调至11时,亚砷酸与氢氧根离子反应生成H2AsO3-,其反应的离子方程为:H3AsO3+OH-=H2AsO3-+H2O;
故答案为:H3AsO3+OH-=H2AsO3-+H2O;
(3)①亚磷酸(H3PO3),该酸与足量的NaOH溶液反应生成 Na2HPO3,说明盐为正盐,亚磷酸为弱酸,则 Na2HPO3为强碱弱酸盐,溶液显碱性,溶液PH>7,
故答案为:正盐;>;
②阴极上得电子发生还原反应,电极反应式为2H++2e-=H2↑;产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3,
故答案为:2H++2e-=H2↑;HPO32-+2H+=H3PO3.
点评 本题考查了元素化合物的性质的综合应用、盐类水解、溶液中离子浓度大小比较、离子方程式的书写、电解原理应用等,题目难度中等,侧重于基础知识的综合应用能力的考查,注意把握题目中的信息以及对图象的分析理解.


科目:高中化学 来源: 题型:选择题
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 氢氧燃料电池工作过程中,热能转变为电能 | |
| C. | 电解水制取H2过程中,电能转变为化学能 | |
| D. | 生物质能源是可再生能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
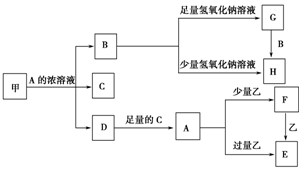 中学化学中常见的几种物质存在如图关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体.(图中部分产物和反应条件已略去)
中学化学中常见的几种物质存在如图关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体.(图中部分产物和反应条件已略去)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝反应放出H2的溶液Na+、NH4+、Cl?、NO3- | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42-、I? | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl?、HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知有H、C、N、O、Na、Si、Cl、Ca、Fe等元素,请回答下列问题:
已知有H、C、N、O、Na、Si、Cl、Ca、Fe等元素,请回答下列问题: (写出一种即可).
(写出一种即可).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com