
| A、向水中加入NaHSO4溶液 |
| B、向水中加入Na2CO3溶液 |
| C、向水中加入Al2(SO4)3固体 |
| D、加热 |


科目:高中化学 来源: 题型:
| A、Fe2+、NH4+、Cl-、NO3- |
| B、K+、CO32-、Cl-、SO42- |
| C、Ca2+、Na+、NO3-、HCO3- |
| D、Na+、H+、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲、丁、戊的单质都是金属 |
| B、乙、丙、辛都是非金属元素 |
| C、乙、庚、辛都能形成氧化物 |
| D、已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、做一次完整的中和热测定实验,温度计至少需使用3次 |
| B、在有盐桥构成的铜(硫酸铜)-锌(硫酸锌)原电池中,盐桥中的阳离子移向电池的锌极 |
| C、利用盖斯定律可间接计算通过实验难测定的反应的反应热 |
| D、可以借助分光光度计采用比色的方法测定某反应的化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:

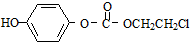 ,该物质在NaOH水溶液中加热反应时的化学方程式为
,该物质在NaOH水溶液中加热反应时的化学方程式为 的合成路线流程图(无机试剂任用).合成路线流程图例如下:CH2═CH2
的合成路线流程图(无机试剂任用).合成路线流程图例如下:CH2═CH2| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
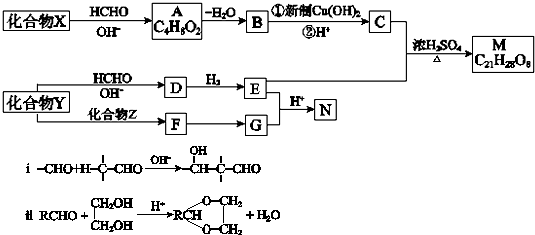
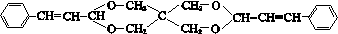
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
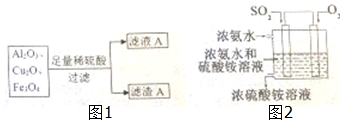
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com