
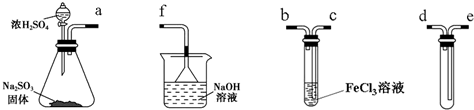
分析 (1)配制氯化铁溶液时,应加相应的酸抑制铁离子水解,在烧杯中稀释配制溶液;
(2)根据实验目的,先是制备二氧化硫,然后是让二氧化硫和氯化铁之间反应,但是之前要进行防倒吸,最后进行尾气处理;
(3)倒置漏斗可防止NaOH溶液倒吸;
(4)氯化铁中通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁;
(5)①发生氧化还原反应,生成硫酸根离子、亚铁离子;
②检验有Fe2+生成,利用KSCN和氯水,先不变红,后变红分析;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性.
解答 解:(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在浓盐酸中,再加水稀释,这样操作的目的是抑制铁离子水解,故答案为:浓盐酸;
(2)根据实验目的,先是制备二氧化硫,用第一个装置,用最后一个装置,导管要短进长出,可以防止倒吸,然后是让二氧化硫和氯化铁之间反应,即第三个装置,最后进行尾气处理,顺序是:d、e、c、b、f,故答案为:d;e;c;b;f;
(3)因尾气易溶于NaOH溶液,则倒置漏斗的作用为防止NaOH溶液倒吸,故答案为:使气体充分吸收,防止溶液倒吸;
(4)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁,则观察到溶液由棕黄色变为浅绿色,故答案为:溶液由棕黄色变为浅绿色;
(5)①发生氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3++SO2+2H2O=SO42-+4H++2Fe2+,故答案为:2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;
②检验有Fe2+生成的实验方法为取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红,
故答案为:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验,故做法不合理,
故答案为:硝酸可以将溶解的SO2氧化为H2SO4,干扰试验.
点评 本题考查性质实验方案的设计及实验装置综合,为高频考点,把握装置中发生的反应及氧化还原反应原理的应用为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
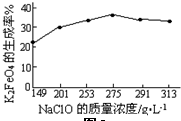
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
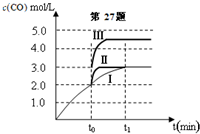 甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其氢氧化物中碱性最强的是LiOH | |
| B. | 离子的氧化能力最强的是Cs+ | |
| C. | 原子半径随核电荷数的增大而增大 | |
| D. | 单质的熔点随相对原子质量的增大而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 所示.
所示. 出发来合成M,其合成路线如下:
出发来合成M,其合成路线如下:
 .
. .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com