
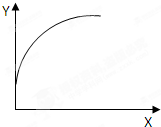
 在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)=2C(g)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)=2C(g)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )| X | Y | |
| A | 温度 | 混合气体平均相对分子质量 |
| B | 再加入C | A的质量分数 |
| C | 再加入A | B的转化率 |
| D | 压强 | B的浓度 |
| A. | A | B. | B | C. | C | D. | D |
分析 反应2A(g)+B(g)=2C(g)+Q(Q>0),增加A的量,促进B的转化,加入C,化学平衡逆向移动,增大压强,平衡正向移动,升高温度,化学平衡逆向移动,结合图象可知一个量增大引起另一个量的增大来解答.
解答 解:A、达平衡后,升高温度,化学平衡逆向移动,由混合气体平均相对分子质量=$\frac{m}{n}$可知,逆向移动时n增大,则混合气体平均相对分子质量减小,与图象不符合,故A错误;
B、达平衡后,再加入C,等效于成比例改变生成物,所以先成比例扩大体积,A的质量分数不变,再压缩,化学平衡正向移动,则A的质量分数减小,与图象不符合,故B错误;
C、达平衡后,再加入A,平衡正向移动,促进B的转化,即B的转化率增大,与图象符合,故C正确;
D、达平衡后,增大压强,平衡正向移动,则B的浓度减小,与图象不符合,故D错误;
故选C.
点评 本题考查化学平衡的影响因素及化学平衡图象,明确不同因素对化学平衡的影响及由图象得出一个量增大引起另一个量的增大是解答本题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的原子序数依次增大 | |
| B. | X与Z形成的化合物为离子化合物 | |
| C. | X与Y形成的化合物只含共价键 | |
| D. | 存放Z单质的仓库失火不能用CO2灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
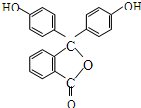
| A. | 酚酞的分子式是C20H12O4 | B. | 分子中的所有碳原子不在同一平面 | ||
| C. | 1mol酚酞最多可能消耗2mol NaOH | D. | 1mol酚酞可与10mol H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焚烧树叶,以减少垃圾运输量 | |
| B. | 将废弃塑料就地烧掉,以消除“白色污染” | |
| C. | 加高工厂烟囱,以减少二氧化硫对环境的污染 | |
| D. | 运输沙土的车辆盖上苫布,以免增加空气中的粉尘含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com