
| A. | 若金属有剩余,向溶液中再滴入硫酸后,金属可能溶解,也可能不溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 | |
| D. | 当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-$\frac{a}{3}$) |
分析 A.溶液中有硝酸根时,再加入酸,溶液具有强氧化性,金属能溶解;
B.金属全部溶解,Fe可能以Fe2+形式存在;
C.若金属全部溶解,失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,反应中硝酸起氧化剂、酸性作用,根据N元素守恒计算起氧化剂作用的硝酸的浓度;
D.反应中失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,得失电子数目相同.
解答 解:A.若金属有剩余,说明溶液中有硝酸根,在溶液中再滴入硫酸后,相当于又存在了硝酸,金属均能溶解,故A错误;
B.当铁的量较多时,可以将生成的三价铁再还原为亚铁,溶液中不一定含有Fe3+,故B错误;
C.硝酸中N元素的化合价由+5价到+2价,当产生336mL(标准状况),即0.015mol一氧化氮时,显示氧化性的硝酸为0.015mol,所以起氧化剂的硝酸的浓度c=$\frac{0.015mol}{0.05L}$=0.3mol/L,还有一部分硝酸显示了酸性,即b>0.3,故C错误;
D.根据铁和铜与硝酸的反应,作酸性的硝酸在Fe(NO3)3和Cu(NO3)2中,为3y(1-a)+2yamol,作氧化性的硝酸,得到的电子等于Fe、Cu失去的电子,由于NO是唯一的还原产物,所以作氧化性的硝酸为$\frac{3y(1-a)+2ya}{3}$mol,所有硝酸的总量为$\frac{4[3y(1-a)+2ya]}{3}$=4y(1-$\frac{a}{3}$),c(HNO3)=$\frac{4y(1-\frac{a}{3})}{0.05L}$=80y(1-$\frac{a}{3}$),因为硝酸还可能有剩余,所以b≥80y(1-$\frac{a}{3}$),故D正确.
故选:D.
点评 本题考查氧化还原反应的计算,题目难度中等,注意物质氧化性、还原性的比较,结合质量守恒和得失电子守恒计算.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
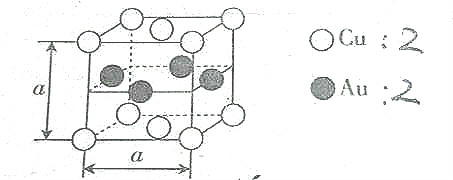
| A. | 该合金属于离子晶体 | B. | 该合金中Au的配位数是4 | ||
| C. | 该合金中Cu的配位数是8, | D. | 该合金的硬度低于Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都可以 | B. | 只有①不能发生 | C. | 只有②不能发生 | D. | 只有①④不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当容器中X与Y的物质的量浓度之比满足1:2时,反应达到平衡 | |
| B. | 达到平衡后,反应速率3v正(Y)=2v逆(z) | |
| C. | 达到平衡时,X的转化率为25%,则平衡常数K值为$\frac{1}{16}$ | |
| D. | 达到平衡后,升高温度,X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l);△H=-Q1 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-Q2 kJ•mol-1 | |
| C. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1 | |
| D. | $\frac{1}{3}$H3PO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{6}$Ba3(PO4)2(s)+H2O(l);△H=-Q4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置可验证酸的强弱规律.
利用如图装置可验证酸的强弱规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水中有平衡:Br2+H2O=HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 在电解含有酚酞的硫酸钠溶液时,阴极附近溶液的颜色变红 | |
| C. | 对CO+NO2=CO2+NO,平衡体系增大压强可使颜色变深 | |
| D. | 合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
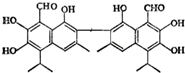 中央电视台曾报道纪联华超市在售的某品牌鸡蛋为“橡皮弹”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋.专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致.其结构简式如图所示:下列说法不正确的是( )
中央电视台曾报道纪联华超市在售的某品牌鸡蛋为“橡皮弹”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋.专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致.其结构简式如图所示:下列说法不正确的是( )| A. | 该化合物的分子式为:C30H30O8 | |
| B. | 1mol棉酚最多可与10mol H2加成,与6molNaOH反应 | |
| C. | 在一定条件下,可与乙酸反应生成酯类物质 | |
| D. | 该物质可以使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 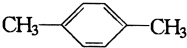 | ||
| C. |  (立方烷) (立方烷) | D. | 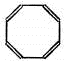 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com