
| A. | 非金属性:X<Y<Z | |
| B. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| C. | 原子半径:按X、Y、Z变小 | |
| D. | 气态氢化物稳定性:按X、Y、Z顺序减弱 |
分析 X、Y、Z三种元素原子的核电荷数在10~18之间,它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,X、Y、Z的最高化合价分别为+7、+6、+5,则X为Cl,Y为S,Z为P,非金属性Cl>S>P,据此结合元素周期律的知识进行判断.
解答 解:X、Y、Z三种元素原子的核电荷数在10~18之间,它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,X、Y、Z的最高化合价分别为+7、+6、+5,则X为Cl,Y为S,Z为P,非金属性Cl>S>P,
A.X为Cl,Y为S,Z为P,非金属性Cl>S>P,即:X>Y>Z,故A错误;
B.非金属性Cl>S>P,则最高价氧化物对应的水化物的酸性:HXO4>H2YO4>H3ZO4,故B错误;
C.同一周期中,原子半径越大,非金属性越弱,非金属性Cl>S>P,则原子半径X<Y<Z,即原子半径按X、Y、Z变大,故C错误;
D.非金属性Cl>S>P,则气态氢化物的稳定性为:HX>HY>HZ,即对应气态氢化物的稳定性按X、Y、Z顺序减弱,故D正确;
故选D.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,根据元素周期律的内容正确推断元素为解答关键,注意明确原子结构与元素周期律之间的关系,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤的气化、液化均为化学变化,而石油的常压蒸馏和减压蒸馏均是物理变化 | |
| B. | 绿色化学的核心就是利用化学原理吸收处理工业生产污染物并将其转化为有用物质 | |
| C. | 利用石油的裂化可以提高汽油的产量和质量 | |
| D. | 将苦卤水浓缩、氧化,鼓入空气和水蒸气可提取溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓 时间 度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
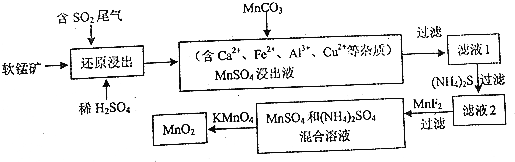
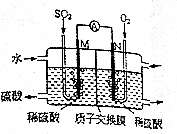
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
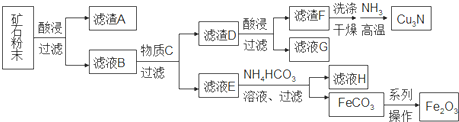
| A. | 在生成Cu3N的反应中,氨气做氧化剂 | |
| B. | 加入NH4HCO3溶液在生成白色沉淀的同时会放出有刺激气味的气体 | |
| C. | 虑液G可以并入滤液E加以利用 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水在结冰时体积膨胀,是由于水分子之间存在氢键 | |
| B. | NH3的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 在氨水中水分子和氨分子之间也存在着氢键 | |
| D. | 分子间作用力较弱,破坏它所需能量较少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯和溴水混合后加入Fe粉制溴苯 | |
| B. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,振荡,若无油滴浮在液面上,说明油脂已完全反应 | |
| C. | 检验淀粉在稀硫酸催化条件下水解产物的方法是:取适量水解液于试管中,加入少量新制Cu(OH)2悬浊液,加热煮沸,观察是否出现红色沉淀 | |
| D. | 探究化学反应的限度:取5ml 0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5-6滴,充分反应,根据溶液中是否含有碘单质和碘离子判断该反应有一定限度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com