
| 事 实 | 结 论 | |
| A | CaCO3+2CH3COOH=(CH3COO)2Ca+CO2↑+H2O | 酸性:CH3COOH>H2CO3 |
| B | 氢硫酸(H2S)放置在空气中变浑浊 | 氧化性:O2>S |
| C | Al(OH)3既溶于强酸又溶于强碱 | Al元素既有金属性也有非金属性 |
| D | 反应A+2B?C达平衡后,升高温度平衡正向移动 | 升高温度,使v正增大、v逆减小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.根据强酸制取弱酸原理分析;
B.变浑浊说明反应生成S单质,结合氧化还原反应中氧化剂的氧化性大于氧化产物分析;
C.氢氧化铝为两性氢氧化物,说明Al具有一定的金属性和非金属性;
D.升高温度后正逆反应速率都增大.
解答 解:A.根据反应CaCO3+2CH3COOH=(CH3COO)2Ca+CO2↑+H2O可知酸性:CH3COOH>H2CO3,故A不选;
B.氢硫酸(H2S)放置在空气中变浑浊,说明硫化氢被氧化成S碘单质,氧气为氧化剂、S为氧化产物,则氧化性:O2>S,故B不选;
C.Al(OH)3既溶于强酸又溶于强碱,为两性氢氧化物,可以说明Al元素既有一定的金属性也有非金属性,故C不选;
D.升高温度,反应速率增大,则升高温度,使v正增大、v逆也增大,故D选;
故选D.
点评 本题考查化学实验方案的评价,题目难度不大,涉及酸性强弱比较、氧化还原反应、反应速率及其影响等知识,试题知识点较多,充分考查了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 用热的纯碱溶液洗去油污,原理是Na2CO3溶液水解显碱性 | |
| C. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| D. | 光导纤维的主要成分是晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某反应正、逆反应的活化能分别为EakJ/mol、EbkJ/mol,则△H=-(Ea-Eb)kJ/mol | |
| B. | H2的热值为142.9kJ/g,则有2H2(g)+O2(g)═2H2O (1)△H=-285.8kJ/mol | |
| C. | 将浓度为0.1mol/LHF溶液加水不断稀释过程中,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持减小 | |
| D. | 混合前$\frac{c(C{H}_{3}COOH)}{c(NaOH)}$=2,等体积的混合后溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
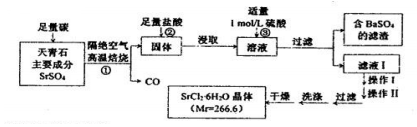
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,8,4,1,4 | B. | 2,16,5,2,8 | C. | 1,6,5,1,3 | D. | 1,8,5,1,4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24 L SO2与O2混合气体中所含氧原子数小于0.2NA | |
| B. | 点解饱和食盐水时,当溶液pH由7变为13,电路中转移的电子数为0.1NA | |
| C. | 常温下,1 L pH=13的Ba(OH)2中含有的OH-数目为0.2NA | |
| D. | 10 mL 98%的H2SO4溶液,加入水中稀释至100 mL,H2SO4的质量分数为9.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molOH-的质量是17g | B. | 1mol气体所占的体积等于22.4L | ||
| C. | 氢气的摩尔质量是2g | D. | 摩尔是物质的质量单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度时的混合溶液中c(H+)=$\sqrt{{K}_{W}}$mol•L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A. | 反应过程中的氧化产物均为Na2HSO4 | |
| B. | a点时剩余NaHSO3的物质的量为1.0 mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO43-+I-+3H2O | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com