
| A、电镀的酸性废液用碱中和后还是不可以排放 |
| B、侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
| C、碘是人体必需微量元素,所以要多吃富含KIO3的食盐 |
| D、室温下,AgCl在水中的溶解度小于在食盐中的溶解度 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
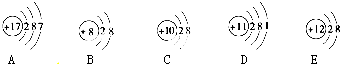
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | ||
| B、等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-=Mg(OH)2↓ | ||
| C、将过量的SO2通入Ca(ClO)2溶液中:SO2+ClO-+H2O=HClO+HSO3- | ||
D、将0.2 mol?L-1的NH4Al(SO4)2溶液与0.3 mol?L-1的Ba(OH)2溶液等体积混合:2Al3++3SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与足量盐酸完全反应时,b耗酸量多 |
| B、与足量盐酸完全反应时,a产生二氧化碳多 |
| C、溶于水后分别加入足量澄清石灰水,b得到的沉淀量多 |
| D、配成等体积的溶液,b溶液中的c(Na+)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃、101.3kPa时,11.2L H2中含有的原子数为NA |
| B、14g N2中含有的原子数为NA |
| C、标准状况下,54mL H2O中含有的分子数为3NA |
| D、2L 1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验 | 分离苯和水 | 用二氧化锰和浓盐酸制取氯气 | 用排气法 收集氨气 | 用四氯化碳萃取 碘水中的碘 |
| 装置 或仪器 |  |  |  |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com