
| A.Mg>Al>Ca | B.Al>Na>Li |
| C.Al>Mg>Ca | D.Mg>Ba>Al |
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:不详 题型:填空题
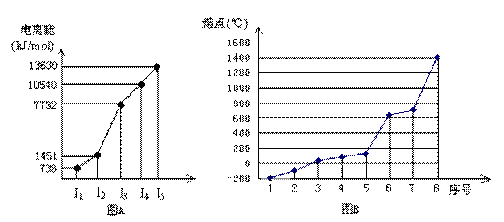
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.①③② | B.②③① | C.③①② | D.②①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
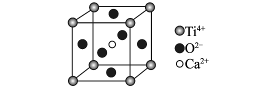
| A.分子晶体中都存在共价键 |
| B.CaTiO3晶体中每个Ti4+与12个O2-相邻 |
| C.SiO2晶体中每个硅原子与两个氢原子以共价键相结合 |
| D.金属晶体的熔点都比分子晶体的熔点高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
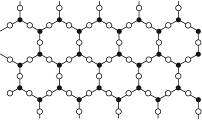
| A.晶体中Si与O的数目比是1∶4 |
| B.晶体中Si与O的数目比是1∶6 |
| C.该物质是原子晶体 |
| D.该物质是分子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
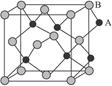
| A.AB | B.A2B | C.AB2 | D.A2B3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
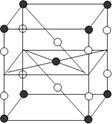
| A.XeF2分子中各原子均达到八电子结构 |
| B.某种氟化氙的晶体结构单元如右图,可推知其化学式为XeF6 |
| C.XeF4按已知方式水解,每生成4molXe,转移16mol电子 |
| D.XeF2加入水中,在水分子作用下将重新生成Xe和F2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 晶体名称 | 组成晶体微粒 | 晶体内作用力 |
| A | 碘化钾 | 阴阳离子 | 离子键 |
| B | 干冰 | 分子 | 共价键 |
| C | 晶体硅 | 原子 | 共价键 |
| D | 碘 | 分子 | 范德华力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com