
【题目】硝酸越稀还原产物中氮元素的化合价越低。某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出。在反应后的溶液中逐渐加入4mol·L-1NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示(不考虑沉淀的微量溶解)。下列说法不正确的是
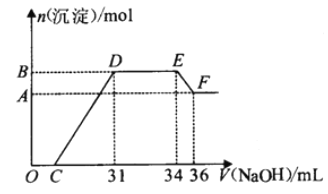
A. D点溶液中存在:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-)
B. EF段发生反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
C. D点溶液中n(NH4+)=0.012mol
D. 由水电离产生的c(H+):O点>F点
【答案】D
【解析】铁铝合金与足量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,由于硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3 ↓,Al3++3OH-=Al(OH)3 ↓,③NH4++OH-═NH3·H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
A、D点溶液溶质为硝酸铵和硝酸钠,由电荷守恒可知应为c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-),故A正确;B、EF段为氢氧化铝溶于氢氧化钠的反应,Al(OH)3+OH-=AlO2-+2H2O,故B正确;C、由图可知DE段消耗氢氧化钠的体积为3mol,由NH4++OH-═NH3·H2O,可知溶液中n(NH4+)=n(OH-)=0.003L×4mol·L-1=0.012mol,故C正确;D、由图可得硝酸过量,O点HNO3抑制水电离,F点NaAlO2溶液是强碱弱酸盐,水解促进水电离,故D错误,故选D。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关金属元素特征的叙述正确的是
A.金属元素的原子只有还原性,其阳离子只有氧化性
B.金属元素的单质在常温下都为固体
C.含金属元素的离子都是阳离子
D.金属阳离子被还原不一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016年浙江卷】化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用如下路线合成X和Z:

已知:①化合物A的结构中有2个甲基
②RCOOR′+R′′CH2COOR′![]()
![]()
请回答:
(1)写出化合物E的结构简式__________,F中官能团的名称是_________。
(2)Y→Z的化学方程式是____________。
(3)G→X的化学方程式是__________,反应类型是___________。
(4)若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:

(1)甲池中通入CH4电极的电极反应为___________________________________。
(2)乙池中A(石墨)电极的名称为________(填“正极”、“负极”或“阴极”、“阳极”), 乙池中总反应式为____________________________________ 。
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为______mL(标准状况),丙池中______(填“C”或“D”)极析出_______g铜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l);△H=﹣285kJ/mol
O2(g)=H2O(l);△H=﹣285kJ/mol
②H2O(g)=H2(g)+![]() O2(g);△H=+241.8kJ/mol
O2(g);△H=+241.8kJ/mol
③C(s)+![]() O2(g)=CO(g);△H=﹣110.4kJ/mol
O2(g)=CO(g);△H=﹣110.4kJ/mol
④C(s)+O2(g)=CO2(g);△H=﹣393.5kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是 .(用序号填写)
(2)C的燃烧热为 .
(3)燃烧10g H2生成液态水,放出的热量为 .
(4)CO的燃烧热的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是
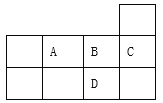
A. 原子半径大小为:B>A>C
B. 核电荷数:D > C>B >A
C. A与D形成的化合物均是离子键
D. 生成的氢化物的稳定性为: D >A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配位化合物的数量巨大,组成和结构形形色色,丰富多彩。请指出配合物 [Cu(H2O)4](OH)2的中心离子、配体、中心离子的电荷数和配位数
A.Cu2+、H2O、+2、4 B.Cu+、H2O、+1、4
C.Cu2+、OH-、+2、2 D.Cu2+、H2O、+2、2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质熔化或气化时,所克服的微粒间的作用力属同种类型的是
A.SiO2和干冰的熔化 B.氧化钠和钠的熔化
C.晶体硅和晶体硫的熔化 D.碘和干冰的气化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有广阔的海岸线,海水综合利用大有可为。海水中溴含量为 65 mg/L,从海 水中提取溴的工业流程如下:

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:_____。
(2)步骤Ⅱ通入热空气或水蒸气吹出 Br2,利用了溴的________。
A.氧化性B.还原性C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:_____
![]()
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出 溴与二氧化硫水溶液反应的离子方程式:________。由此反应可知, 除环境保护外,在工业生产中应解决的主要问题是_______。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________。
A.乙醇 B.四氯化碳 C.氢氧化钠溶液 D.苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com