
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:选择题
某工厂运输NH3的管道出现小孔导致NH3泄漏,技术人员常常用一种液体进行检查,你觉得该液体最有可能是
A. 浓盐酸 B. 烧碱溶液 C. 浓硫酸 D. 碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考试化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是

A. 原子半径:X<Y<Z
B. 气态氢化物的稳定性:X>Z
C. 最高价氧化物对应水化物的酸性:Y>W
D. Z、W均可与Mg形成离子化合物
查看答案和解析>>
科目:高中化学 来源:广西南宁市2017届高三第一次模拟测试理综化学试卷 题型:实验题
某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体。回答下列问题:
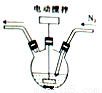
(1)碘化亚铁溶液的制备:将碘和铁粉按物质的量之比在 之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
①配料中铁粉过量的目的是____________;持续通入N2的目的是___________。
②检验反应液中不含碘单质的方法是___________。
(2)碘化钠溶液的制备:将制备好的碘化亚铁溶液加入碳酸氢钠溶液中,控制碘化亚铁与碳酸氢钠的物质的量之比在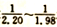 ,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
(3)点化钠的提纯与结晶:
①除去碘化钠溶液中以HCO3-的方法是____________。
②从碘化钠溶液中获得碘化钠晶体(20℃时溶解度为179/100g水,100℃时溶解度为302/100g水)的操作方法是________________。
(4)碘化钠的提度的测定:
该小组同学称取制得的碘化钠晶体18.1g,溶于水后加入50mL2.5mol/LAgNO3溶液,过滤、洗涤、干燥,称得沉淀的质量为28.2g。则碘化钠晶体的纯度为_________。(杂质不参与反应,结果保留至小数点后两位)
查看答案和解析>>
科目:高中化学 来源:广西南宁市2017届高三第一次模拟测试理综化学试卷 题型:选择题
化学在生活中有着广泛的应用,下列对应关系错误的是
选项 | 化学性质 | 实际应用 |
A | ClO2具有强氧化性 | 自来水消毒杀菌 |
B | SO2具有还原性 | 用作漂白剂 |
C | NaHCO3受热易分解并且生成气体 | 焙制糕点 |
D | Al(OH)3分解吸收大量热量并有H2O生成 | 阻燃剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师范大学附属中学高一3月月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是( )
A. Z2Y B. X2Y2 C. Z2Y2 D. ZYX
查看答案和解析>>
科目:高中化学 来源:2017届河北省石家庄市高三下学期模拟联考理科综合化学试卷(解析版) 题型:填空题
化合物C是一种合成药品的中间体,其合成路线为:
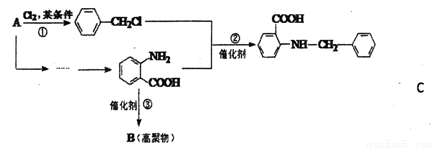
已知: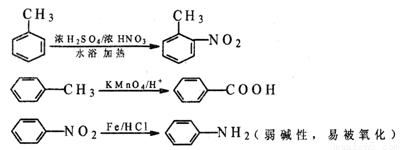
(1)写出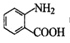 中宮能团的名称_____________。
中宮能团的名称_____________。
(2)写出反应①的化学方程式_________________。
(3)反成②属于_______反应(填有机反应类型)。
(4)D是比 多一个碳的同系物,则满足下列条件的D的间分异构体共有______种,写出一种满足条件且含4种不同氢原+的同分异构体的结构简式 __________。
多一个碳的同系物,则满足下列条件的D的间分异构体共有______种,写出一种满足条件且含4种不同氢原+的同分异构体的结构简式 __________。
①显弱碱性,易被氧化 ②分子内含有苯环 ③能发生水解反应
(5)请你设计由A合成B的合成路线。 __________
提示:①合成过程中无机试剂任选;②合成路线表示方法示例如下:
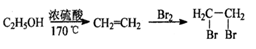
查看答案和解析>>
科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:选择题
铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H+(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(烃基自由基)。下列说法错误的是
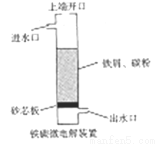
A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e-=H·
C. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
科目:高中化学 来源:山东省2016-2017学年高一3月月考化学试卷 题型:选择题
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是
 A.X单质不易与水反应 B.XO2可被碳或氢还原为X
A.X单质不易与水反应 B.XO2可被碳或氢还原为X
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com