
(1)K2SO4和Al2(SO4)3混合溶液中c(K+)=0.2mol·L-1,c(SO42-)=0.7mol·L-1。
①写出Al2(SO4)3的电离方程式: 。
②c(Al3+)等于 mol·L-1。
(2)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
①除去Mg2+,需要加入的碱溶液为(从下列选项中选出答案,填字母,下同): ;除去SO42-,需要加入的盐溶液为: ;
A.NaOH B.KOH C.BaCl2 D.Ba(NO3)2
②经过操作①后再加入饱和Na2CO3溶液,直至不再产生沉淀为止。这步操作的目的是:除去 和 。(填写离子符号)
③将经过操作②后的悬浊液过滤,滤液中还有两种杂质。为了除去这两种杂质,最后在滤液中加入的溶液是(填溶质化学式) ;
写出除去这两种杂质发生反应的离子方程式 、 。
科目:高中化学 来源:2016-2017学年安徽省高一上阶段测二化学卷(解析版) 题型:选择题
下列各组在溶液中的反应,不管反应物的量是多少,都能用同一离子方程式表示的是()
A.FeBr2与Cl2 B.Ba(OH) 2与H2SO4
C.HC1与 Na2CO3 D.NaHCO3与Ca (OH) 2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省三明市高一上期中化学试卷(解析版) 题型:填空题
一个体重50kg的健康人含铁2g,这2g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在.亚铁离子易被吸收,给贫 血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁.
血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁.
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是____________.
A.Fe B.Fe2+ C.Fe3+
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有_________性.下列也能实现这种转化的物质是____________(填字母序号).
A.Cl2 B. H2 C.FeCl2 D.浓硫酸
(3)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有_______________性.
(4)Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O的反应中,HNO3表现了____________性和____________性,每有1mol Cu参加反应,被还原的HNO3为____________mol,转移电子数____________mol.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省三明市高一上期中化学试卷(解析版) 题型:选择题
在标准状况下,与32g O2的体积相等的N2 ( )
A.质量为14g B.分子数为6.02×1024 C.体积为22.4L D.物质的量为2 mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省三明市高一上期中化学试卷(解析版) 题型:选择题
下列化合物中,不能通过单质直接化合制取的是( )
A.FeCl3 B.CuCl2 C.HCl D.FeCl2
B.CuCl2 C.HCl D.FeCl2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上学期期中化学试卷(解析版) 题型:选择题
已知R2-核外有a个电子,b个中子,表示R原子组成的符号正确的是( )
A. 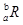 B.
B.  C.
C. 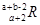 D.
D. 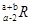
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上学期期中化学试卷(解析版) 题型:选择题
以下表示的是碳及其化合物的相互转化关系: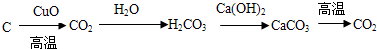
其中涉及的基本反应类型从左到右依次为( )
A.置换、化合、复分解、分解 B.置换、化合、分解、复分解
C.化合、置换、分解、复分解 D.化合、置换、复分解、分解
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上月考四化学试卷(解析版) 题型:实验题
高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
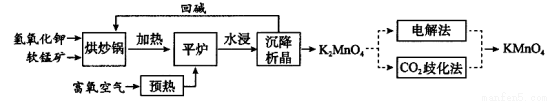
回答下列问题:
(1)“平炉”中发生的化学方程式为 。
(2)“平炉”中需要加压,其目的是 。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③CO2的等电子体COS,分子 COS电子式为_____________。
(4)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L?1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液滴定,滴定终点现象 ,该反应中,氧化剂与还原剂的物质的量之比 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五县七校高一上期中化学试卷(解析版) 题型:实验题
某化学实验小组需要1mol·L-1的CuSO4溶液90ml,现用CuSO4·5H2O晶体来配制,请回答下列问题:
(1)实验时,应用托盘天平称取CuSO4·5H2O晶体 g。
(2)配制过程中,不需要的仪器(填序号) 。
A药匙 B量筒 C烧杯 D玻璃棒 E蒸发皿
完成实验还缺少的玻璃仪器是 。
(3)定容时的操作:当液面接近容量瓶刻度线时, ,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(4)下列操作会使配得的CuSO4溶液浓度偏高的是________。
A.CuSO4·5H2O已失去部分结晶水 |
B.定容时仰视容量瓶的刻度线 |
C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线 |
D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制 |
E.容量瓶内壁附有水珠而未干燥处理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com