
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:阅读理解
 Ⅰ.下列实验操作或对实验事实的描述不正确的是
Ⅰ.下列实验操作或对实验事实的描述不正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 试验方法 |
| 检验氯化亚铁是否变质 | D D |
| 除去食盐中少量细沙 | C C |
| 除去碳酸钠固体中少量碳酸氢钠 | A A |
| 除去镁粉中混有的少量铝粉 | B B |
查看答案和解析>>
科目:高中化学 来源: 题型:
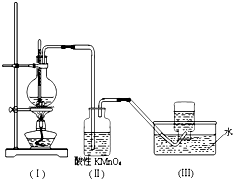 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色.
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色.查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南唐河县第一高级中学高一下学期第三次月考化学卷(带解析) 题型:实验题
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯: CH3CH2OH CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
酸性高锰酸钾溶液褪色,甲同学认为能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为不能证明乙烯被酸性高锰酸钾溶液氧化了。
(1)你认为哪个同学的观点正确? _____ (填“甲”或“乙”),理由是(从下列选项中选)_____
| A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了氧化反应 |
| B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了加成反应 |
| C.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,不能证明通入的气体是纯净物 |
| D.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,只能证明通入的气体一定具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.下列实验操作或对实验事实的描述不正确的是______ (填序号).
Ⅰ.下列实验操作或对实验事实的描述不正确的是______ (填序号).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com