
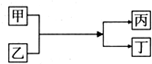
| A. | 若甲为铜,丁为氯化亚铁,则乙一定是氯化铁 | |
| B. | 若甲为水,丁为氢氧化钠,则丙一定是氢气 | |
| C. | 若甲为铝,丁为铁,则乙一定是氧化铁 | |
| D. | 若甲为镁,丁为氢气.则乙一定是酸 |
分析 A.若甲为铜单质,丁为氯化亚铁,根据质量守恒,则乙一定是氯化铁;
B.若甲为水,丁为氢氧化钠,乙为钠或过氧化钠;
C.C.若甲为铝单质,丁为铁单质,属于铝热反应,乙为铁的氧化物,则乙也可以是四氧化三铁;
D.若甲为镁,丁为氢气,则乙可能为水,也可能为酸性溶液,不一定是酸,如氯化铵溶液.
解答 解:A.若甲为铜单质,丁为氯化亚铁,根据质量守恒,则乙一定是氯化铁,故A正确;
B.若甲为水,丁为氢氧化钠,乙可能为钠,也可能是过氧化钠,则丙可能为氢气,也可能为氧气,故B错误;
C.若甲为铝单质,丁为铁单质,属于铝热反应,乙为铁的氧化物,则乙可能为氧化铁,也可能为四氧化三铁,故C错误;
D.若甲为镁,丁为氢气,则乙可能为水,也可能为酸性溶液,可能为酸,也可能为盐,如氯化铵溶液,故D错误,
故选A.
点评 本题考查无机物推断,基本属于开放性题目,需要学生熟练掌握元素化合物知识,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与Z同族的第五周期元素的原子序数为50 | |
| B. | Y的简单氢化物的沸点和热稳定性均大于R的简单氢化物 | |
| C. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2,且均能与水反应 | |
| D. | 由W和Z组成的ZW物质硬度大、熔沸点高,具有导磁性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
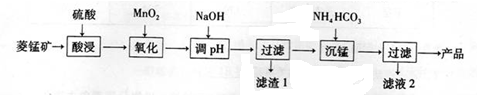
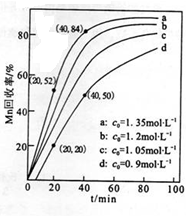
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长期放置的漂白粉是因与空气中的氧气发生反应而变质 | |
| B. | 粗硅提纯是利用H2作还原剂,将硅从其氯化物中还原出来 | |
| C. | 利用半透膜除去海水中的NaCl、MgCl2等离子化合物可获得淡水 | |
| D. | 工业上用铝热反应来冶炼Fe、Cr、Mn、V等稀有金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁溶于稀硝酸,溶液变为浅绿色Fe+4H++NO3 --=Fe3++NO↑+2H2O | |
| B. | 向K2Cr2O7溶液中加少量浓硫酸,溶液变为黄色Cr2O7 2-(橙色)+H2O?2CrO4 2-(黄色)+2H+ | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝4H++4I-+O2=2I2+2H2O | |
| D. | 稀的氨水溶液吸收了少量的二氧化碳气体NH3•H2O+CO2=NH4++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于12.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com