
| A. | Mg(OH)2[Al(OH)3] | B. | MgCl2(AlCl3) | C. | Mg(Al) | D. | MgO(Al2O3) |
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
| 物质 | CO | H2 | CH3OH |
| 浓度(mol•L-1) | 0.9 | 1.0 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a-b+2 | B. | $\frac{N(a-b-2)}{a}$ | C. | $\frac{N(a-b+2)}{a}$ | D. | a-b-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4 NH3.H20═Al02-+4NH4++2H20 | |
| B. | 澄清石灰水与足量小苏打溶液混合:Ca2++2OH-+2 HCO3-═CaC03+CO32-+2 H2O | |
| C. | 食醋腐蚀大理石面板:CaCO3+2 H+═Ca2++CO2+H2O | |
| D. | 少量钠投入硫酸铜溶液中:2Na+Cu2+═2 Na++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式 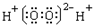 | |
| B. | 氨分子的结构式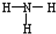 | |
| C. | S2-的结构示意图 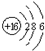 | |
| D. | 原子核内有20个中子的氯原子${\;}_{37}^{17}Cl$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Al3+、Cl- | B. | Na+、OH-、K+、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、SO42-、HCO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com