
 ′
′ .
.分析 环己烯 与溴发生加成反应生成A为
与溴发生加成反应生成A为 ,A在氢氧化钠水溶液、加热条件下发生水解反应生成B为
,A在氢氧化钠水溶液、加热条件下发生水解反应生成B为 ,A发生消去反应生成
,A发生消去反应生成 ,
, 发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为醇、C发生氧化反应生成E为羧酸,故F、E含有相同碳原子数目,由F发生取代反应生成环醚G的分子式可知,C中含有2个C原子,则D为OHCCH2CH2CHO,C为OHC-CHO,则F为HOCH2CH2OH、E为HOOC-COOH,2分子HOCH2CH2OH发生脱水反应生成环醚G为
发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为醇、C发生氧化反应生成E为羧酸,故F、E含有相同碳原子数目,由F发生取代反应生成环醚G的分子式可知,C中含有2个C原子,则D为OHCCH2CH2CHO,C为OHC-CHO,则F为HOCH2CH2OH、E为HOOC-COOH,2分子HOCH2CH2OH发生脱水反应生成环醚G为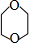 ,F与E通过酯化反应进行的缩聚反应生成聚酯H为
,F与E通过酯化反应进行的缩聚反应生成聚酯H为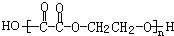 .D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,I在浓硫酸、加热条件下生成J,J分子中无饱和碳原子,应发生消去反应,可推知J为CH2=CHCH=CH2,J发生加聚反应得到合成橡胶
.D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,I在浓硫酸、加热条件下生成J,J分子中无饱和碳原子,应发生消去反应,可推知J为CH2=CHCH=CH2,J发生加聚反应得到合成橡胶 ,据此解答.
,据此解答.
解答 解:环己烯 与溴发生加成反应生成A为
与溴发生加成反应生成A为 ,A在氢氧化钠水溶液、加热条件下发生水解反应生成B为
,A在氢氧化钠水溶液、加热条件下发生水解反应生成B为 ,A发生消去反应生成
,A发生消去反应生成 ,
, 发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为醇、C发生氧化反应生成E为羧酸,故F、E含有相同碳原子数目,由F发生取代反应生成环醚G的分子式可知,C中含有2个C原子,则D为OHCCH2CH2CHO,C为OHC-CHO,则F为HOCH2CH2OH、E为HOOC-COOH,2分子HOCH2CH2OH发生脱水反应生成环醚G为
发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为醇、C发生氧化反应生成E为羧酸,故F、E含有相同碳原子数目,由F发生取代反应生成环醚G的分子式可知,C中含有2个C原子,则D为OHCCH2CH2CHO,C为OHC-CHO,则F为HOCH2CH2OH、E为HOOC-COOH,2分子HOCH2CH2OH发生脱水反应生成环醚G为 ,F与E通过酯化反应进行的缩聚反应生成聚酯H为
,F与E通过酯化反应进行的缩聚反应生成聚酯H为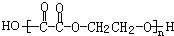 .D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,I在浓硫酸、加热条件下生成J,J分子中无饱和碳原子,应发生消去反应,可推知J为CH2=CHCH=CH2,J发生加聚反应得到合成橡胶
.D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,I在浓硫酸、加热条件下生成J,J分子中无饱和碳原子,应发生消去反应,可推知J为CH2=CHCH=CH2,J发生加聚反应得到合成橡胶 ,
,
(1)反应③是卤代烃发生的消去反应,反应条件是:NaOH醇溶液、加热,
故答案为:NaOH醇溶液、加热;
(2)H为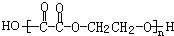 ,H的名称是聚乙二酸乙二酯,
,H的名称是聚乙二酸乙二酯,
故答案为:聚乙二酸乙二酯;
(3)B为 ,I为HOCH2CH2CH2CH2OH,所以B和I的关系为都属于醇类,
,I为HOCH2CH2CH2CH2OH,所以B和I的关系为都属于醇类,
故答案为:C;
(4)根据上面的分析可知,③~⑩中属于取代反应的有⑦⑧,
故答案为:⑦⑧;
(5)反应⑩是CH2=CHCH=CH2发生加聚反应得到 ,反应方程式为:
,反应方程式为:
故答案为: ;
;
(6)D为OHCCH2CH2CHO,D的属于酯类的链状同分异构体的结构简式为CH2=CHCOOCH3、HCOOCH2CH=CH2,
故答案为:CH2=CHCOOCH3、HCOOCH2CH=CH2.
点评 本题考查有机物的推断,需要学生对给予的信息进行利用,能较好的考查学生的自学能力,利用正推法与逆推法相结合进行推断,需要熟练掌握官能团的性质,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属(M表示金属)被腐蚀的本质是:Mn++ne-=M | |
| B. | 金属不可能在碱性环境中发生电化学腐蚀 | |
| C. | 镀锌铁的镀层破损后,镀层仍能对铁起保护作用 | |
| D. | 钢管与外加直流电源的正极相连,以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸、氯化铁均为胶体 | B. | 水玻璃、氯水均为混合物 | ||
| C. | 食醋、纯碱、食盐分别属于酸、碱盐 | D. | 氨气属于非电解质,Cu属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲>乙>丙>丁 | B. | 丙>丁>乙>甲 | C. | 丙>丁>甲>乙 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一无色透明的溶液做如下实验:
一无色透明的溶液做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该混合溶液中一定含有Fe2+、NO3-、NH4+、SO42- | |
| B. | 白色沉淀甲一定是Al(OH)3 | |
| C. | 该混合溶液中肯定含有Fe2+、NH4+、CO32-、NO3- | |
| D. | 向该混合溶液中滴加酚酞试液后呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36 L NO2与水充分反应转移的电子数为0.1NA | |
| B. | 12 g金刚石中含有的共价键数为4NA | |
| C. | 将22.4 L Cl2通入足量水中,反应转移的电子数为NA | |
| D. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com