
NA表示阿伏加罗常数的值,下列说法正确的是
A.1 mol Cl2与过量的镁反应,转移 2NA个电子
B.常温常压下,16 g CH4含有 10NA个电子
C.1 mol·L -1 Na2SO4溶液中含有 NA个SO42-
D.常温常压下,22.4 L CO2含有N A个CO2分子
 53天天练系列答案
53天天练系列答案科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D.②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:实验题
能源、环境与人类的生活和社会发展密切相关。低碳、环保,能源的综合利用是是当今的热门话题。英国蒂斯河畔斯托克顿市的“空气燃料合成公司冶竟真的发明出了一种将空气变成汽油的高科技技术,而美国科学家最早设计出以甲烷等碳氢化合物为燃料的新型电池,大大提高天然气的利用效率。据此,回答下列问题:
(1)“空气变汽油”这项科技解决环境问题的意义是_______________________;
(2)“空气变汽油”其原理可简化如下:
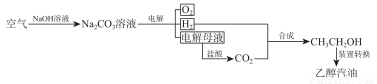
则:
①合成路线中,NaOH 和盐酸都可以循环利用,写出有关反应式______________________;
②转变过中,100g5%Na2CO3溶液,电解后,溶液浓度变为10%,则生成标准状况下的氢气多少升?
(3)天然气燃料电池最大的障碍是氧化反应不完全,产生________ (填写化学式)堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间。
(4)以下是天然气燃料电池电解精炼铜的装置图:
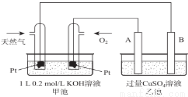
则,①甲池反应的离子方程式为______________________;
②当乙池中某电极的质量增重12.8g 时,理论上甲池中消耗的CH4在标准状况下的体积为__________mL,甲池中溶液的pH约为__________(溶液的体积变化忽略不计);此时向甲池中加入1 L1.0×10-3mol/L的CaCl2溶液,则甲池中________(填“有”或“无”)沉淀生成[已知Ksp(CaCO3)=2.9×10-9]。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟八化学试卷(解析版) 题型:填空题
原子序数依次增大的前四周期元素 A、B、C、D、E中,A 和 C 的最外层电子数相同,B 的电负性是所有元素中最大的元素,C 的电子层数等于最外层电子数,D 的最外层电子数在本周期中除稀有气体外最多的原子,E 元素核外电子排布为[Ar]3d104s1。
(1)A、C、D 三种元素中电负性最小的是____________(填元素符号,下同);B 的第一电离能________D 的第一电离能(填“>”、“<”或“=”)。
(2)B的氢化物分子间存在的作用力含__________;E基态原子的核外电子排布式是____________。
(3) A与B 形成的化合物AB3,该分子中心原子杂化方式为__________;该化合物的空间构型为_________。
(4)常温常压下,C与D所形成的化合物熔点为190℃,沸点为178℃,推断该化合物晶体类型为______;用惰性电极电解ESO4溶液,阳极的电极方程式为________________。
(5)把C的氢氧化物加入到D的氢化物的稀溶液中,离子方程式为______;
(6)单质A12结构模型如图所示,则该晶体结构模型中,A—A 键的数目为________个。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟八化学试卷(解析版) 题型:填空题
已知A和G都为常见金属单质,它们之间能发生如下反应(部分产物未标出)
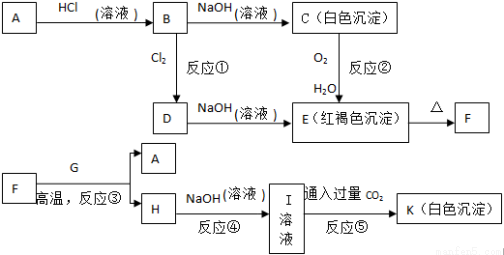
请根据以上信息回答下列问题:
(1)写出物质B的化学式_____________、H的化学式___________;
(2)写出反应①(B到D)的离子方程式___________;写出反应②(C到E)的化学方程式___________;写出反应⑤的化学方程式___________;
(3)若反应③中转移了0.3mol电子,则生成A为___________克。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟八化学试卷(解析版) 题型:选择题
下列试剂在空气中久置因为O2而变质的是
A.Na2O2 B.Ca(ClO)2 C.FeSO4 D.浓盐酸
查看答案和解析>>
科目:高中化学 来源:2016届青海省西宁市等校高三下联考理综化学试卷(解析版) 题型:实验题
市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
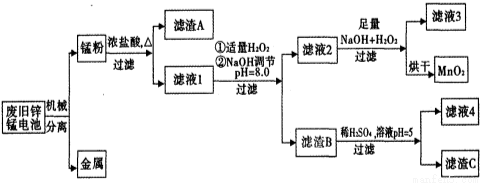
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 / Mn(OH)3 |
开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
完全沉淀pH(c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是___________________________________;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=____________________。
(2)滤液1中加入H2O2的作用是________________________________________。
(3)写出滤液2中的Mn2+变成MnO2的离子方程式_______________________________。
(4)写出滤渣B与稀硫酸在pH=5时反应的化学方程式_____________________________。
(5)工艺中还可以将滤液4进行_____________、_____________、_____________、洗涤得到含结晶水的硫酸盐晶体。
(6)MnO2常用来制取KMnO4。在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液阳极电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三5月月考理综化学试卷(解析版) 题型:选择题
a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是
A.d元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有a与其他元素生成的化合物都是离子化合物
D.b、c、d与氢形成的化合物中化学键均为极性共价键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江双鸭山一中高二下期中化学试卷(解析版) 题型:选择题
下列说法中正确的一组是( )
A.H2和D2互为同素异形体;
B.正丁烷和异丁烷是同系物;
C. 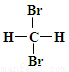 和
和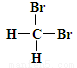 互为同分异构体
互为同分异构体
D.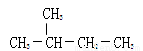 和
和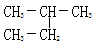 是同一种物质
是同一种物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com