
【题目】下列根据实验事实得出的结论正确的是
实验事实 | 结论 | |
A | 某物质在熔融态下能导电 | 该物质一定是电解质 |
B | 某溶液中加入BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
C | SO2的水溶液能导电 | SO2为电解质 |
D | 已知:Cl2+2FeCl2=2FeCl3反应能发生 | 氧化性:Cl2>FeCl3 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】现实验室需要450 mL 0.5 mol/L的NaOH溶液和500 mL 0.2 mol/L的H2SO4溶液。
请回答下列问题:
Ⅰ.配制NaOH溶液
【1】根据计算,用托盘天平称取NaOH固体的质量应为_____g。
A.0.9B.9.0C.10D.10.0
Ⅱ.配制稀H2SO4
某同学欲用质量分数为98%的浓硫酸(密度ρ=1.84 g/cm3)配制所需的稀H2SO4。可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒;⑤500 mL容量瓶;⑥圆底烧瓶
【2】以上仪器中不需要的是
A.①B.②C.③D.⑥
【3】用量筒量取所需浓硫酸的体积应为_______mL。
A.5.4B.5.5C.18.4D.27.2
【4】如果实验室有10 mL、20 mL、50 mL的量筒,应选用_______mL量筒量取。
A.10B.20C.50D.以上都可以
【5】下列操作会使所配制的溶液浓度偏高的是
A.容量瓶中原来有少量蒸馏水未作处理
B.定容时仰视容量瓶刻度线
C.用量筒量取浓硫酸时仰视读数
D.定容时,不慎加水超过刻度线,又用滴管将多出部分吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由 Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有________个未成对电子。Fe3+的电子排布式为_______________。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为________,1 mol乙醛分子中含有的σ键的数目为________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有__________个铜原子。锗也是一种半导体材料,Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是______________________________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图:

镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,其中A、B、C、D、E代表元素。下列说法错误的是
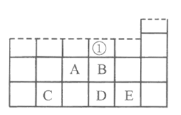
A.元素B、D对应族①处的标识为ⅥA16
B.熔点:D的氧化物<C的氧化物
C.AE3分子中所有原子都满足8电子稳定结构
D.E的含氧酸酸性强于D的含氧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。下列叙述错误的是( )
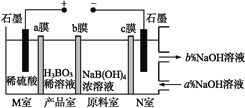
A. M室发生的电极反应式:2H2O-4e-![]() O2↑+4H+
O2↑+4H+
B. N室:a<b
C. 产品室发生的反应是B(OH)4- +H+![]() H3BO3+H2O
H3BO3+H2O
D. 理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X,含有![]() 、
、![]() 、
、![]() 和
和![]() 中的几种,进行如下实验:
中的几种,进行如下实验:
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与![]() 溶液作用,无变化。
溶液作用,无变化。
下列说法不正确的是( )
A.混合物X中必定含有![]() ,不含
,不含![]()
B.溶液Z中溶质主要是钠盐,且必含![]()
C.灼烧沉淀Y,可能得到黑色物质
D.往溶液Z中加入Cu粉,若不溶解,说明X中不含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
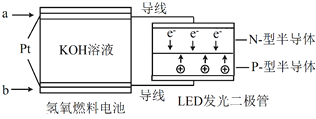
A. 电路中的电子从负极经外电路到正极,再经过KOH溶液回到负极,形成闭合回路
B. a处通入氢气, b处通氧气,该装置将化学能最终转化为电能
C. 电池放电后, OH-的物质的量浓度减小
D. 通入O2的电极发生反应:O2 + 4e- = 2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。
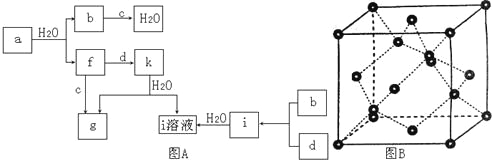
回答下列问题:
(1)图B对应的物质名称是_________,其晶胞中的原子数为______,晶体类型为_______。
(2)d中元素的原子核外电子排布式为_______。
(3)图A中由二种元素组成的物质中,沸点最高的是______,原因是______,该物质的分子构型为_________,中心原子的杂化轨道类型为_________。
(4)图A中的双原子分子中,极性最大的分子是_________。
(5)k的分子式为_________,中心原子的杂化轨道类型为_________,属于_________分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Cu2S(s)![]() CuO(s)
CuO(s)![]() CuCl2(aq)
CuCl2(aq)
B.SiO2(s)![]() H2SiO3(s)
H2SiO3(s)![]() Na2SiO3(aq)
Na2SiO3(aq)
C.Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
D.NaCl(aq)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com