
| A.硬度比生铁低 | B.与4mol/L的HCl反应时速率比生铁快 |
| C.在冷的浓硫酸中可钝化 | D.在潮湿的空气中不易生锈 |
科目:高中化学 来源:不详 题型:实验题
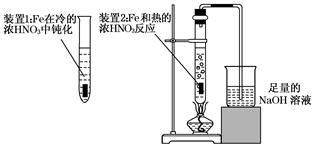
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
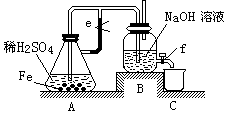
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
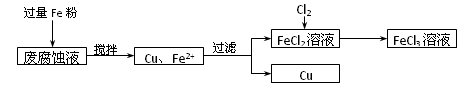
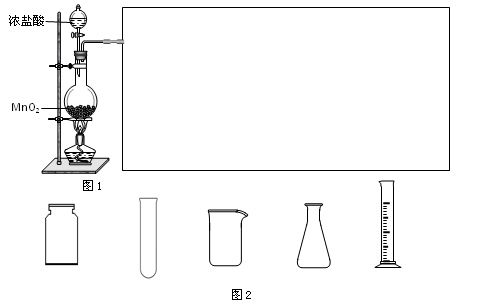
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
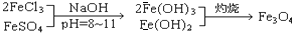
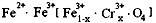 ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
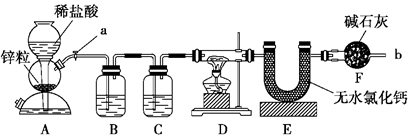
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.对阳极区溶液呈蓝色的正确解释是:2I--2e-=I2,碘遇淀粉变蓝 |
| B.对阳极区溶液呈蓝色的正确解释是:Cu-2e-=Cu2+,Cu2+显蓝色 |
| C.阴极区溶液呈红色的原因是:2H++2e-=H2↑,使阴极附近OH-浓度增大,溶液显碱性,从而使酚酞变红 |
| D.阴极上的电极反应式为:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。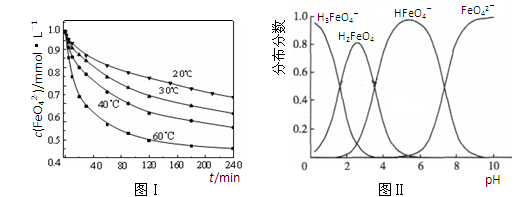

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com