
反应2SO2+O2⇌2SO3,经过一段时间后,O2的浓度增加了4mol/L,在这段时间内用O2表示的反应速率为0.4mol/(L•s),则这段时间为()
A. 0.1 s B. 2.5 s C. 5 s D. 10 s
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
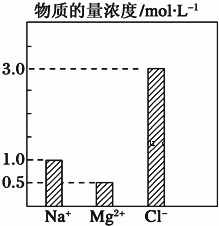
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
(1)该混合液中含溶质MgCl2的物质的量为 ,
(2)将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1mol C10H22含共价键数目32NA
B. 常温常压下,8g CH4含有电子数目5NA
C. 1L 0.1mol•L﹣1的醋酸溶液中含有CH3COO﹣的数目0.1NA
D. 78g苯含有C=C双键的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17.
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”): ,理由是
(2)Y是 ,Z是 ,W是 ;
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1.写出该化合物的名称及化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的实验组别可能是()
组别 c(HCl)(mol/L) 温度(℃) 状态
1 2.0 25 块状
2 2.5 30 块状
3 2.5 50 块状
4 2.5 30 粉末状
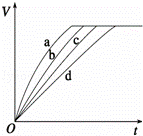
A. 4﹣3﹣2﹣1 B. 1﹣2﹣3﹣4 C. 3﹣4﹣2﹣1 D. 1﹣2﹣4﹣3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=﹣4b kJ/mol
B. C2H2(g)+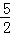 O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
C. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol
D. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L容器中发生3A+B═2C的反应,最初加入的A、B都是4mol,10s 内A的反应速率为0.12mol/(L•s),10s后容器内的B的物质的量为()
A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体.铜液吸收CO的反应是放热反应,其化学方程式为:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac,若要提高上述反应的正反应速率,可采取的措施是
①增加NH3的浓度 ②降温 ③减压 ④及时移走产物()
A. ① B. ②③ C. ③④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
反应:N2(g)+3H2(g)⇌2NH3(g)△H<0.在等容条件下进行.体系中各物质浓度随时间变化的曲线如图1所示,回答问题:
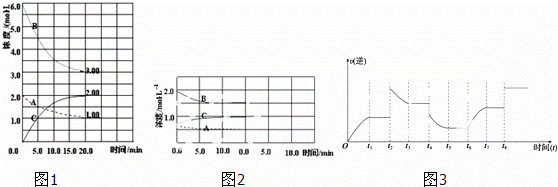
(1)图1中B为 (填“N2”、“H2”或“NH3”)计算反应从开始→达平衡时H2的反应速率v(H2)=
(2)图1是在某温度下反应达到平衡,将容器的体积扩大一倍,假定10min后达到新的平衡,请在图2中用曲线表示体系中各物质的浓度随时间变化的趋势(不需计算新平衡时的具体浓度,只要新平衡时浓度处于一个合理范围内即可.曲线上必须标出N2、H2、NH3).
(3)若该反应的逆反应速率与时间的关系如图3所示:反应在t1、t3、t5、t7时都达到了平衡,而t2、t4、
t6、t8时都改变了条件,试判断改变的条件是(填“升温”、“降压”…等);t2时 ;t6时 ;t4时,平衡向 (填“正”或“逆”)反应方向移动.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com