
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中![]() 增大
增大
C. 在pH=8的NaB溶液中:c(Na+)﹣c(B﹣)=9.9×10﹣8mol![]() L﹣1
L﹣1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
【答案】D
【解析】A. 向0.1 mol·L-1 CH3COOH溶液中加入少量水,稀释电离常数Ka= 不变,溶液中c(CH3COO-)减小,所以
不变,溶液中c(CH3COO-)减小,所以![]() 增大,故A错误;B. 将CH3COONa溶液从20 ℃升温至30 ℃,升温促进盐类水解,水解常数Kh=
增大,故A错误;B. 将CH3COONa溶液从20 ℃升温至30 ℃,升温促进盐类水解,水解常数Kh=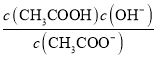 增大,溶液中
增大,溶液中![]() 减小,故B错误;C. 在pH=8的NaB溶液中,电荷守恒:c(Na+)+ c(H+)=c(B﹣)+ c(OH-),c(H+)=10-8mol/L ,c(OH-)=10-6mol/L,c(Na+)-c(B﹣)= c(OH-)-c(H+)=9.9×10﹣7mol
减小,故B错误;C. 在pH=8的NaB溶液中,电荷守恒:c(Na+)+ c(H+)=c(B﹣)+ c(OH-),c(H+)=10-8mol/L ,c(OH-)=10-6mol/L,c(Na+)-c(B﹣)= c(OH-)-c(H+)=9.9×10﹣7mol![]() L﹣1,故C错误;D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
L﹣1,故C错误;D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 =
=![]() ,
, 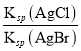 不变,所以
不变,所以![]() 不变,故D正确。故选D。
不变,故D正确。故选D。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A. 提高溶液的温度
B. 将溶液稀释到原体积的10倍
C. 加入适量的醋酸钠固体
D. 加入等体积0.2 mol·L-1盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是①Al2O3②NaHSO4③NaHCO3④Al(OH)3⑤Na2CO3( )
A.①③④B.②③⑤C.②④⑤D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁
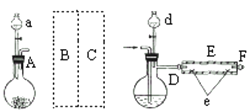
请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性________.
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________,②________.
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:______________________________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作的描述中,正确的是( )
A.从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.酒精灯不慎碰倒起火时可用水扑灭
D.各放一张质量相同的滤纸于天平的托盘上,将NaOH固体放在左盘纸上称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙醇的分子组成为CH3CH2OH,而不是CH3OCH3,最充分的理由是 ( )
A. 1 mol乙醇与足量钠反应放出0.5 mol氢气
B. 1 mol乙醇完全燃烧需要3 mol氧气
C. 1 mol生成2 mol二氧化碳和3 mol水
D. 4.6 g乙醇在标准状况下的体积为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料有许多优点,但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:________________________________。
(2)氢气可用于制备H2O2。
已知:H2(g)+A(l)===B(l) ΔH1
O2(g)+B(l)===A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)===H2O2(l)的ΔH________0(填“>”“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) ![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变 b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大 d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下某容积不变的密闭容器中,可逆反应C(s)+H2O(g)![]() CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
A. 体系的压强不再发生变化 B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2 D. 1 mol H—H键断裂的同时断裂2 mol H-O键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com