
| A. | 原子数 | B. | 体积 | C. | 分子数 | D. | 质量 |
分析 A.稀有气体是单原子分子,氢气为双原子分子;
B.物质的量一定条件下,温度、压强会影响气体的体积;
C.由N=nNA可知,二者物质的量相等则含有分子数目相等;
D.氢气与氦气的摩尔质量不相等.
解答 解:A.氢气是双原子分子,稀有气体是单原子分子,二者含有的原子数目之比为2:1,故A错误;
B.气体摩尔体积与温度和压强有关,温度和压强未知,导致无法判断其体积大小,故B错误;
C.由N=nNA可知,等物质的量的氢气和氦气含有分子数目相等,故C正确;
D.氢气的摩尔质量是2g/mol,氦气的摩尔质量是4g/mol,根据m=nM知,等物质的量的氢气和氦气,其质量不同,故D错误;
故选:C.
点评 本题考查阿伏伽德罗定律及推论等,比较基础,注意温度、压强对气体摩尔体积的影响,基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
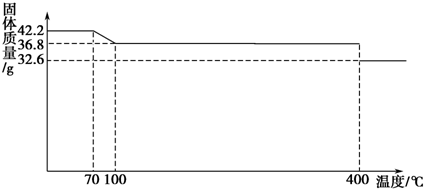
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活性炭、氯气都能使品红溶液褪色 | |
| B. | 苯、乙醇、纤维素都能与浓硝酸反应 | |
| C. | 乙烯、氯乙烯都能使溴水褪色 | |
| D. | 淀粉、蛋白质都能发生显色(或颜色)反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂可增大该反应速率 | |
| B. | 增大O2的浓度能加快反应速率 | |
| C. | 该反应达到平衡时,正、逆反应速率相等但不为0 | |
| D. | 一定条件下,2 mol SO2和1 mol O2反应可以得到2 mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1 mol水的体积约为22.4L | |
| B. | 只有在标准状况下,气体的摩尔体积才是22.4mol/L | |
| C. | 在标准状况下,1molH2和O2的混合气体体积约为22.4 L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
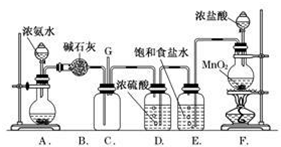
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
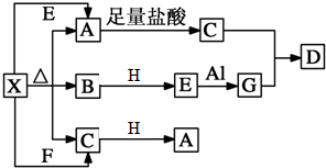
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.7mol•L-1•min | B. | v (B)=0.3mol•L-1•min | ||
| C. | v (C)=0.9mmin | D. | v (D)=1.1mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com