
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| C. | 检验蔗糖水解产物,可向水解样品中直接加入银氨溶液做银镜反应的实验 | |
| D. | 钠和乙醇的反应现象,钠沉在试管底部,有气泡,反应缓慢 |
分析 A.实验中常用饱和食盐水代替水,目的减缓电石与水的反应速率;
B.苯酚与氢氧化钠溶液反应;
C.检验醛基应在碱性条件下;
D.与水相比较,乙醇密度较小,钠与乙醇反应时,钠沉在乙醇液面的下面,钠与乙醇反应不如钠与水反应剧烈,可生成乙醇钠和氢气,钠的熔点比乙醇的沸点高,钠在乙醇中反应不会熔化成小球.
解答 解:A.由于电石和水的反应很剧烈,所以实验中常用饱和食盐水代替水,目的减缓电石与水的反应速率,故A正确;
B.苯不溶于水,苯酚与氢氧化钠溶液反应,可分液分离,故B正确;
C.应在碱性条件下发生氧化还原反应,应在碱性条件下发生氧化还原反应,故C错误;
D.钠在乙醇液面以下,钠不融化,与乙醇反应,缓缓产生气泡,在钠的表面产生氢气,故D正确.
故选C.
点评 本题考查化学实验方案的设计,为高频考点,涉及有机物的制备与性质、有机物的检验等,把握性质及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题
 某化学小组设计如图装置完成一组实验;
某化学小组设计如图装置完成一组实验;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有4种无色液态物质:己烯、己烷、苯和甲苯.按要求填空:
有4种无色液态物质:己烯、己烷、苯和甲苯.按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有Fe3+ |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
| C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰颜色为紫色 | 原溶液中一定只含K+ |
| D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见红色沉淀生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
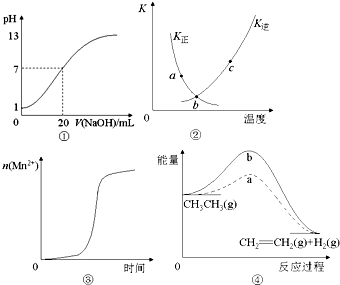
| A. | 图①表示25℃时,用0.1 mol•L-1NaOH溶液滴定20 mL 0.1 mol•L-1 盐酸溶液,溶液的pH随加入NaOH溶液体积的变化 | |
| B. | 图②中表示反应2SO2(g)+O2(g)?2SO3(g);△H<0的有关曲线,图中a.b.c三点中只有b点已经达到化学平衡状态. | |
| C. | 图③表示10 mL 0.01 mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4 溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) | |
| D. | 图④中a、b曲线分别表示反应CH3CH3→CH2=CH2 (g)+H2(g);△H>0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5 种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在碱金属元素中,所有碱金属的氧化物(包括过氧化物)均属于碱性氧化物 | |
| B. | 由于钠、钾的密度都小于1,所以,碱金属单质的密度都小于1 | |
| C. | 金属锂不能保存于煤油中,金属钾可以保存于煤油中 | |
| D. | 虽然自然界含钾的物质均易溶于水,但土壤中钾含量太少,故需施用钾肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com