
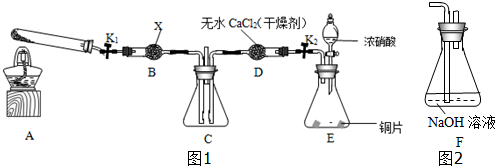
分析 (1)浓硝酸和铜反应生成硝酸铜、二氧化氮和水;
(2)A装置是利用大试管加热反应制备氨气,化学反应是固体氯化铵和氢氧化钙混合加热反应得到氨气,氨气是碱性气体,应用碱石灰干燥;
(3)若NO2能够被NH3还原,则混合气体的颜色将变浅;
(4)实验过程中,未能观察到C装置中的预期现象,说明二氧化氮反应的量很少,可能是反应速率降低,或者二氧化氮的转化率较低;
(5)有毒气体不能直接排放到空气中,需要增加吸收装置防止污染空气;
(6)假设1:二者不反应;假设2:NO2能被Na2O2氧化;假设3可能是NO2能被Na2O2还原;
(7)①验证假设2,首先要制取二氧化氮,因为水能和过氧化钠反应,所以要除去水的干扰,使二氧化氮气体通过过氧化钠,最后要进行尾气处理;
②过氧化钠变成白色固体且为纯净物,根据氧化还原反应中元素化合价的变化确定生成物,过氧化钠作氧化剂,则二氧化氮中氮元素失电子化合价升高而作还原剂,所以氮元素只能转化为+5价,且生成物是纯净物,所以是硝酸钠.
解答 解:(1)浓硝酸和铜反应生成硝酸铜、二氧化氮和水,反应方程式为:Cu+4HNO3 (浓)═Cu(NO3)2+2NO2↑+2H2O,离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)A装置是利用大试管加热反应制备氨气,化学反应是固体氯化铵和氢氧化钙混合加热反应得到氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,氨气是碱性气体,应用碱石灰干燥,所以X中试剂为碱石灰;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,碱石灰;
(3)二氧化氮是红棕色气体,如果能被氨气还原,二氧化氮浓度减小生成无色气体氮气,则C装置中混合气体颜色变浅;
故答案为:C装置中混合气体颜色变浅;
(4)造成未能观察到C装置中的预期现象可能原因是:在此条件下,该反应的化学反应速率极慢或NO2的转化率极低导致反应现象变化不明显;
故答案为:在此条件下,该反应的化学反应速率极慢;
(5)二氧化氮是有毒气体,氨气是有刺激性气味的气体,所以都不能直接排空,要进行尾气处理才能排空,
故答案为:缺少尾气吸收装置;
(6)探究NO2能否与Na2O2发生氧化还原反应,依据假设1和假设2分析,利用的原理是氧化还原反应,所以假设3应是NO2可能被Na2O2还原;
故答案为:NO2能被Na2O2还原;
(7)①验证假设2,首先要用E装置制取二氧化氮,因为制取的二氧化氮气体中含有水蒸气,水能和过氧化钠反应而造成干扰,所以要用D装置除去水蒸气,然后较纯净的二氧化氮通过B装置,未反应的二氧化氮有毒不能直接排空,所以最后要进行尾气处理,选用F装置处理尾气,所以装置的合理连接顺序是EDBDF或EDBF,
故答案为:EDBDF或EDBF;
②B装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成,过氧化钠作氧化剂,则二氧化氮中氮元素失电子化合价升高而作还原剂,所以氮元素只能转化为+5价,且生成物是纯净物,所以是硝酸钠,反应方程式为2NO2+Na2O2═2NaNO3;
故答案为2NO2+Na2O2═2NaNO3.
点评 本题考查了探究二氧化氮性质的实验,根据元素的化合价来预测物质具有的性质,然后根据实验现象判断物质具有的性质,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电池的总反应式:Cd+2NiOOH+2H2O$?_{充电}^{放电}$2Ni(OH)2+Cd(OH)2 | |
| B. | 电池充电时,镉元素被还原 | |
| C. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| D. | 电池充电时,电池的负极和电源的正极连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量,②最大 | |
| D. | 向溶液中加入100 mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
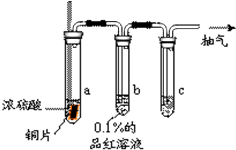 某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).
某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com