
【题目】人的骨骼肌细胞的细胞质内含有的多糖和核酸主要是( )
A. 糖原和DNA B. 糖原和RNA
C. 淀粉和DNA D. 淀粉和RNA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
①少量Cl2通入FeI2溶液中:Cl2+2I=2Cl+I2
②Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
③向次氯酸钙溶液中通入少量SO2:Ca2++2ClO+H2O+SO2=CaSO3↓+2HClO
④FeBr2溶液与等物质的量Cl2反应:2Fe2++2Br+2Cl2=2Fe3++4Cl+Br2
⑤向小苏打溶液中加入过量的澄清石灰水:HCO+Ca2++OH=CaCO3↓+H2O
⑥硫酸氢钠溶液与足量氢氧化钡溶液混合:H++SO![]() +Ba2++OH=BaSO4↓+H2O
+Ba2++OH=BaSO4↓+H2O
⑦Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH+O2↑
A. ①②⑤⑦ B. ①②③⑥ C. ③④⑤⑦ D. ①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A. 化合反应和复分解反应不可能是氧化还原反应
B. 阳离子只能得到电子被还原,阴离子只能失去电子被氧化
C. 含有最高价元素的化合物不一定具有很强的氧化性
D. 在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。
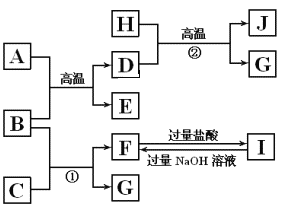
根据图示回答问题:
(1)写出下列物质的化学式:A ______,E______;
(2)反应①的化学方程式是_________________________ ;
反应②的化学方程式是___________________________ ;
(3)J与盐酸反应的化学方程式是______________________ ;
反应后的溶液与足量的D反应的离子方程式是______________________,如何检验最后溶液中的阳离子:______________________________________。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1mol·L1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
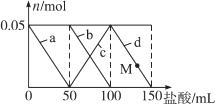
A. a曲线表示的离子方程式为:AlO2-+H++H2O===Al(OH)3↓
B. b和c曲线表示的离子反应是相同的
C. M点时,溶液中沉淀的质量为3.9g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究发现,三种金属或两种金属可以组成准晶体。某准晶体样品M可能由铁、铜和铝中的三种或两种组成。
(实验目的)探究金属的成分
(提出假设)猜想1:M的成分是铁和铜;
猜想2:M的成分是铁和铝;
猜想3:M的成分是______;
猜想4:M的成分是铁、铜和铝
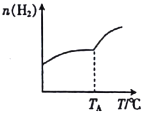
(设计实验)取两份质量均为m g的M样品,按图1和图2装置分别进行实验:实验前后条件都是常温、常压,待样品M充分反应后,按图1、图2实验方案完成实验并测得气体体积分别为V1L和V2L(所测定的气体体积已折合成标准状况)。

(1)完成实验目的和猜想填空内容。________
(2)若该实验需要0.50mol/LNaOH溶液240mL,用规格仪器配制时应称量____g NaOH(用托盘天平),若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度_____(填“偏大”、“偏小”或“无影响”)
(3)进行实验1前,B瓶中的水没有装满,使测得的气体体积_______(填“偏大”、“偏小”或“无影响”),实验2中的导管a的作用为_____________并能防止因加入液体而排出锥形瓶内部分空气,导致测定的气体体积偏大。
(4)若V1≠0,则推测上述猜想________(填“1”、“2”、“3”或“4”)一定不成立,若猜想3成立,则V1________V2(填“>”、“<”或“=”)。
(5)若V1<V2≠0,则M样品中铁的质量为____________g(用含V1和V2式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是

A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
(1)其他条件不变,起始时若按1molCO2、2molH2进行投料,则CO2的转化率将____________(填“增大”“ 减小”或“不变”)。
(2)△H____________ (填“>”“<”或“不能确定”)0。
(3)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
Ⅱ.甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式以及在不同温度下的化学平衡常数如下表所示。
化学反应 |
| 500 | 700 | 800 |
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1. 70 | 2.52 |
③3H2(g)+CO2 (g) | K3 |
请回答下列问题:
(4)根据反应比较△H1__________(填“>”“ <”或“不确定”)△H2。
(5)500℃时测得反应③在某时刻H2(g)、CO2
(6)下列措施能使反应③的平衡体系中![]() 增大的是___________(填字母)。
增大的是___________(填字母)。
A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1molH2
Ⅲ.(7)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g),请你分析该设想能否实现?_______________(填“能”或“不能”),依据是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com