
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:阅读理解
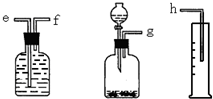 (1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
(1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省瑞安十校高三上学期期末联考理综化学试卷(解析版) 题型:填空题
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素。常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体。C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
(1)D元素在周期表中的位置是: 周期 族。
(2)A与C形成的18电子分子的结构式为: 。
(3)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的B4分子。B4分子结构如图所示,已知断裂l molB-B吸收167kJ热量,生成1 mo1B2放出942kJ热量。根据以上信息和数据,下列说法正确的是 。
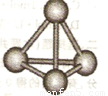
A.B4沸点比P4(白磷)低,属于原子晶体
B.l molB4气体转变为B2吸收882kJ热量
C.B4与B2互为同素异形体
D.B4与B2分子中各原子最外电子层均达到8电子稳定结构
(4)写出过量的F与稀硝酸反应的离子方程式
(5)以D为阳极,在H2SO4溶液中电解,D表面形成氧化膜,阳极电极反应式为 。
(6)在常温,常压和光照条件下,B2在催化剂(TiO2)表面与A2C反应,生成1molBA3(g)和C2时的能量变化值为382.5kJ,此反应BA3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
|
T/K |
303 |
313 |
323 |
|
BA3生成量/(10—1mol) |
4.3 |
5.9 |
6.0 |
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
 B.
B.  C.
C. D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com