

| CH3C=CNa |
 ,E转化得到F,F与氢气发生加成反应生成G,而G转化得到高分子化合物H,应是羟基与羧基发生缩聚反应,故反应④为氧化反应,E被氧化生成F为
,E转化得到F,F与氢气发生加成反应生成G,而G转化得到高分子化合物H,应是羟基与羧基发生缩聚反应,故反应④为氧化反应,E被氧化生成F为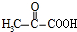 ,则G为
,则G为 ,H为
,H为 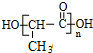 ,据此解答(1)(2)(3);
,据此解答(1)(2)(3);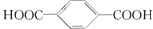 通过缩聚形成的,据此判断合成该涤纶的两种烃的名称.
通过缩聚形成的,据此判断合成该涤纶的两种烃的名称. ,E转化得到F,F与氢气发生加成反应生成G,而G转化得到高分子化合物H,应是羟基与羧基发生缩聚反应,故反应④为氧化反应,E被氧化生成F为
,E转化得到F,F与氢气发生加成反应生成G,而G转化得到高分子化合物H,应是羟基与羧基发生缩聚反应,故反应④为氧化反应,E被氧化生成F为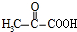 ,则G为
,则G为 ,H为
,H为 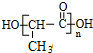 ,
,| 催化剂 |
| H2O |
| △ |
 ,反应方程式为:HOCH2CH(OH)CH3+O2
,反应方程式为:HOCH2CH(OH)CH3+O2| Cu |
| △ |
 +2H2O,
+2H2O,| 催化剂 |
| H2O |
| △ |
| Cu |
| △ |
 +2H2O;
+2H2O; 通过缩聚形成的,其中乙二醇由乙烯通过加成反应、水解反应生成,
通过缩聚形成的,其中乙二醇由乙烯通过加成反应、水解反应生成, 可以由对二甲苯氧化生成,所以这两种烃的结构简式分别为:CH2=CH2、
可以由对二甲苯氧化生成,所以这两种烃的结构简式分别为:CH2=CH2、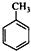 ,故答案为:CH2=CH2;
,故答案为:CH2=CH2; .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝与NaOH溶液反应:2Al+2 OH-+2H2O═2 AlO2-+3H2↑ |
| B、铁与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ |
| C、向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
| D、Na与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
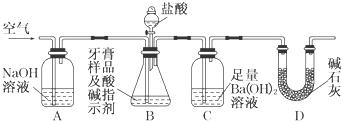
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH |
| | |
| A、2种 | B、3种 | C、4种 | D、5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率 (×10-3mol?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
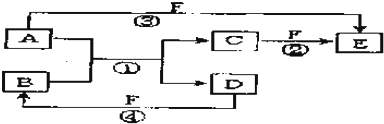
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com