
| ⅠA | 0 | |||||||
| 一 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 二 | R | X | ||||||
| 三 | Y | Z | W | M |
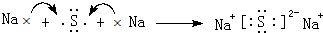 ,
,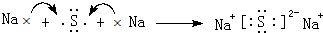 ;
;
| ||
| ||
| ||
| ||


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | A | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A元素的单质可以把B元素的单质从NaB溶液中置换出来 |
| B、NaA、NaB的晶体都是离子晶体,且NaA晶体的熔点比NaB高 |
| C、HA的沸点比HB高,是因为1mol HA分子中H-A键断裂时吸附的能量比1mol HB分子中H-B键断裂时吸收的能量多 |
| D、常温下,NaA、NaB溶液的pH均大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铅蓄电池是典型的可充电型电池,它的正负极格板是惰性材料,电池总反应式为:
铅蓄电池是典型的可充电型电池,它的正负极格板是惰性材料,电池总反应式为:| 放电 |
| 充电 |
| A、放电时:电解液中H2SO4的浓度将变小;正极的电极反应式是PbO2+2e-+4H++SO42-=PbSO4+2H2O |
| B、当外电路通过1mol电子时,理论上负极板的质量增加48g,正极板的质量增加32g |
| C、电池在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成PbO2、B电极上生成Pb |
| D、若按图连接,电解一段时间后,此时铅蓄电池的电极的极性将对换 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com