
 W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,Y元素以Y-X-Y链化合物构成了矿物界.
W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,Y元素以Y-X-Y链化合物构成了矿物界. .
.分析 W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,则W为C元素;W与Y同主族,则Y为Si元素;Y元素以Y-X-Y链化合物构成了矿物界,则X为O元素;X与Z同主族,则Z为S元素;
(1)碳原子最外层有4个电子;
(2)原子数和价电子数都相同的微粒互为等电子体;碳元素的电负性小于氮元素的电负性,碳原子对孤电子对的吸引能力较弱;
(3)根据价层电子对数判断;
(4)先判断中心原子的价层电子对数,再判断杂化方式均;
(5)二氧化硅晶体中每个Si原子周围连接4个O原子;该晶胞中Si原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,O原子数目为16,一个晶胞含有8个“SiO2”结构,所以一个晶胞的质量为$\frac{60×8}{{N}_{A}}$=$\frac{480}{{N}_{A}}$,根据V=$\frac{m}{ρ}$计算体积,再计算立方体的棱长.
解答 解:W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,则W为C元素;W与Y同主族,则Y为Si元素;Y元素以Y-X-Y链化合物构成了矿物界,则X为O元素;X与Z同主族,则Z为S元素;
(1)碳原子的最外层为L层,L层有4个电子,2个在2S上,2个在2P上,且自旋相同,碳的原子价电子的轨道表达式为 ;
;
故答案为: ;
;
(2)CO中有2个原子、价电子为4+6=10,N2、CN-均与CO互为等电子体;CN-作配体时,提供孤电子对的通常是C 原子而不是氮原子,因为碳元素的电负性小于氮元素的电负性,碳原子对孤电子对的吸引能力较弱;
故答案为:CN-;碳元素的电负性小于氮元素的电负性;
(3)SO2中S原子的价层电子对数为2+$\frac{6-2×2}{2}$=3,含有一个孤电子对,则空间构型是V形;
故答案为:V形;
(4)SiF4遇水易发生水解,水解后产生的HF与部分SiF4生成配离子SiF62-,其反应的化学方程式为:3SiF4+4H2O═H4SiO4+2H2SiF6.该反应混合物中,SiF4、H2O、H4SiO4的中心原子的价层电子对数均为4,杂化方式均为sp3杂化;
故答案为:SiF4、H2O、H4SiO4;
(5)二氧化硅晶体中每个Si原子周围连接4个O原子,则硅原子的配位数为4;该晶胞中Si原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,O原子数目为16,一个晶胞含有8个“SiO2”结构,所以一个晶胞的质量为$\frac{60×8}{{N}_{A}}$=$\frac{480}{{N}_{A}}$,已知该晶体的密度为ag/cm3,则V=$\frac{m}{ρ}$=$\frac{\frac{480}{{N}_{A}}}{a}$cm3,则该晶胞的棱长为$\root{3}{\frac{480}{a{N}_{A}}}$×1010pm;
故答案为:4;$\root{3}{\frac{480}{a{N}_{A}}}$×1010.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、电子排布、杂化类型的判断等知识点,明确物质结构、杂化理论、原子结构等知识点是解本题关键,题目难度中等,侧重于考查学生的分析能力和计算能力.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 多糖、蛋白质都是高分子化合物,一定条件下都能水解 | |
| B. | 普通玻璃、钢化玻璃和有机玻璃都是硅酸盐制品 | |
| C. | 分馏、干馏都是物理变化,裂化、裂解都是化学变化 | |
| D. | 尼龙绳、羊绒衫和棉衬衣等生活用品都是由合成纤维制造的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能溶于水 | B. | 能使溴水褪色 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | ||
| X | W |
| A. | X的氧化物是酸性氧化物,只能与碱反应 | |
| B. | X、Y、Z、W的最高价依次升高 | |
| C. | 化合物XW4、YZ中各原子均满足最外层8电子稳定结构 | |
| D. | Y的最简单气态氢化物和W的单质混合可产生白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .如果没有步骤③,D、F能反应吗?能.
.如果没有步骤③,D、F能反应吗?能. .
.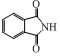 为原料,写出制备
为原料,写出制备 的合成路线流程图(无机试剂任用).CH≡CH$→_{催化剂}^{H_{2}O}$
的合成路线流程图(无机试剂任用).CH≡CH$→_{催化剂}^{H_{2}O}$ →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 按如图所示装置进行实验,以制取乙酸乙酯.
按如图所示装置进行实验,以制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com