
| A. | 6mol | B. | 4.7mol | C. | 3mol | D. | 2.4mol |
分析 两溶液混合,发生反应Ba2++SO42-=BaSO4↓,同时发生Al3++OH-=Al(OH)3↓,当Al3+反应完了,OH-再和NH4+反应:NH4++OH-=NH3•H2O,根据硫酸钡求出Ba2+的物质的量,进而计算出加入的OH-总量,再计算出Al3+完全反应消耗OH-的物质的量,根据离子方程式计算生成Ba(OH)2的物质的量.
解答 解:2mol复盐NH4Al(SO4)2的溶液中电离产生2molNH4+、2molAl3+和4molSO42-,设加入氢氧化钡为xmol,当铝离子未完全沉淀,所以沉淀的质量为:$\frac{2x}{3}$+x=4mol,解之得x=2.4mol,如果铝离子完生转化为偏铝酸盐生成硫酸钡也是4mol,此时需氢氧化钡的物质的量为2.5×2=5mol,只要氢氧化钡大于等于5mol沉淀的质量为4mol,故选AD.
点评 本题考查化学方程式有关计算,为高频考点,明确离子反应先后顺序及氢氧化铝性质是解本题关键,注意以哪种微粒为标准进行计算,为易错题.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | m>n | B. | m=n | C. | m<n | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
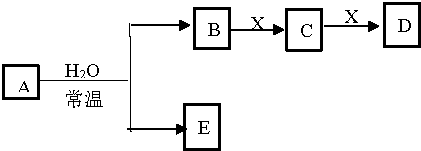
| A. | 若D是白色沉淀,D与A的摩尔质量相等,则X可能是铝盐 | |
| B. | 若X是Na2SO3,C是气体,则A可能是氯气,且D和E能发生反应 | |
| C. | 若D是CO,C能和E反应,则A是Na2O2,X的同素异形体只有3种 | |
| D. | 若A是单质,B和D的反应是,则E一定能还原Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 无法确定硝酸的浓度 | B. | n(NO):n(NO2)=1:1 | ||
| C. | 4.8<m<12.8 | D. | 反应后c(NO${\;}_{3}^{-}$)=4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
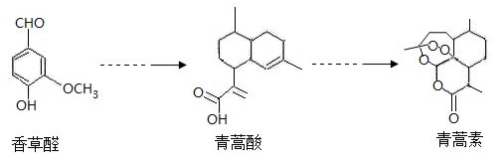
| A. | 青蒿素能发生水解反应 | |
| B. | 青蒿素易溶于乙醚 | |
| C. | 在一定条件下,香草醛可与HCHO发生缩聚反应 | |
| D. | 可用FeCl3 溶液或 NaHCO3溶液鉴别香草醛和青蒿酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用乙二醇的物理性质作内燃机抗冻剂 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 采用光触媒技术可将汽车尾气中的NO和CO转化为无毒气体 | |
| D. | 苦卤经过浓缩、氧化、鼓入热空气或水蒸气,可获得溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 | |
| B. | 称量样品→加热→冷却→称量Mg(NO3)2 | |
| C. | 称量样品→加热→冷却→称量MgO | |
| D. | 称量样品→加NaOH溶液→过滤→加热→冷却→称量MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 常温下,将Al箔插入浓HNO3中,无明显现象 | 铝和浓硝酸不反应 |
| B | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| C | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
| D | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com