
【题目】已知固体Na2SO3受热分解生成两种正盐,实验流程和结果如下:
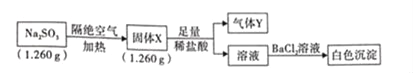
已知:气体Y是一种纯净物,在标准状况下密度为1.518gL﹣1.请回答下列问题:
(1)气体Y的电子式为_____。
(2)实验流程中,Na2SO3受热分解的化学方程式为_____。
(3)另取固体X试样和Na2SO3混合,加适量蒸馏水溶解,再加入稀盐酸,立即有淡黄色沉淀产生。则产生淡黄色沉淀的离子方程式为_____(不考虑空气的影响)。
(4)Na2SO3长期露置在空气中,会被氧化成Na2SO4,检验Na2SO3是否变质的实验操作是_____。
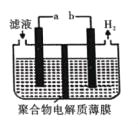
(5)某研究性学习小组通过图所示装置,利用电化学方法处理上述流程中产生的气体Y.基本工艺是将气体Y通入FeCl3,待充分反应后过滤,将所得滤液加入电解槽中进行电解,电解后的滤液可以循环利用。则与a相连的电极反应式为_____。
【答案】![]() 4Na2SO3
4Na2SO3![]() Na2S+3Na2SO4 2S2﹣+SO32﹣+6H+=3S↓+3H2O 取少量亚硫酸钠样品于一支试管中,加入适量蒸馏水溶解,向溶液中加入足量盐酸后,再滴入几滴氯化钡溶液,若生成白色沉淀说明有Na2SO3被氧化为Na2SO4 Fe2+﹣e﹣=Fe3+ 。
Na2S+3Na2SO4 2S2﹣+SO32﹣+6H+=3S↓+3H2O 取少量亚硫酸钠样品于一支试管中,加入适量蒸馏水溶解,向溶液中加入足量盐酸后,再滴入几滴氯化钡溶液,若生成白色沉淀说明有Na2SO3被氧化为Na2SO4 Fe2+﹣e﹣=Fe3+ 。
【解析】
(1)气体Y是一种纯净物,标准状况下密度为1.518g·L-1,则Y的摩尔质量为1.518g·L-1×22.4L·mol-1=34g·mol-1,根据元素守恒,推出Y为H2S,电子式为![]() ;
;
(2)由以上分析可知,气体Y为H2S,以及生成气体Y的条件,推出固体X中含有S2-,即固体X中含有Na2S,溶液中加入BaCl2溶液,出现白色沉淀,该白色沉淀为BaSO4,则固体X中含有Na2SO4,Na2SO3受热分解生成Na2S和Na2SO4,反应的化学方程式为4Na2SO3![]() Na2S+3Na2SO4;
Na2S+3Na2SO4;
(3)固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,即有S单质生成,反应的离子方程式为2S2﹣+SO32﹣+6H+=3S↓+3H2O;
(4)Na2SO3长期露置在空气中,会被氧化成Na2SO4,检验Na2SO3是否变质的实验操作是:取少量亚硫酸钠样品于一支试管中,加入适量蒸馏水溶解,向溶液中加入足量盐酸后,再滴入几滴氯化钡溶液,若生成白色沉淀说明有Na2SO3被氧化为Na2SO4,亚硫酸钠变质;
(5)将气体Y通入FeCl3,发生氧化还原反应吸收二氧化硫,装置图中放出氢气的一端为阴极,b为电源负极,a为电源正极,将所得滤液加入电解槽中进行电解,电解后的滤液可以循环利用,说明亚铁离子在阳极失电子生成了铁离子,电极反应为:Fe2+﹣e﹣=Fe3+。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
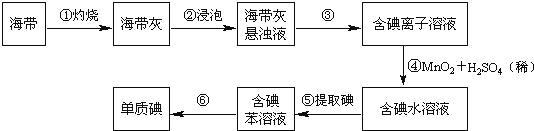
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后______(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种元素原子的质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是( )
A. 由已知信息可得NA=![]()
B. W g该原子的物质的量一定是![]() mol
mol
C. 该原子的摩尔质量是aNA g
D. W g该原子中含有![]() 个该原子
个该原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧层是地球生命的保护伞,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2![]() 2O3。
2O3。
(1)若上述反应中有30%的氧气转化为臭氧,求所得混合气体的平均摩尔质量______(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,求其中臭氧的体积___________。
(3)加热条件下,O3、O2都能与铜粉反应,实验室中将氧气和臭氧的混合气体0.896 L(标准状况下)通入盛有20.0 g铜粉的反应器中,充分加热后,混合气体被完全吸收,粉末的质量变为21.6 g。求原混合气体中臭氧的体积分数___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为ω,物质的量浓度为c mol·L-1,则下列关系中不正确的是( )
A. ω=![]() B. ω=
B. ω=![]()
C. ρ=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,气缸体积一定,内部被活塞隔成ABC三部分,活塞可以自由移动。常温下,A中充入4g氢气, B中充入16g氧气,C中充入4g氦气。
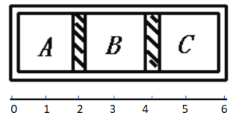
(1)当活塞不移动时,求A、B、C三部分体积比VA:VB:VC。____
(2)拿走A和B之间的活塞,让氢气和氧气充分混合用电火花点燃,恢复到原来的温度,通过计算,判断活塞停止的位置。(用线上数字表示)____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(?)+2D(?),“?”代表状态不确定。5 min后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为15∶14,则下列说法正确的是
4C(?)+2D(?),“?”代表状态不确定。5 min后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为15∶14,则下列说法正确的是
A. 该反应的化学平衡常数表达式是K=[c4(C)·c2(D)]/[c3(A)·c2(B)]
B. 0~5 min内A的反应速率为0.24 mol·L-1·min-1
C. 此时B的平衡转化率是40%
D. 增大该体系的压强,平衡向右移动,化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和用于制药工业。某化学兴趣小组对其性质进行如下探究,回答下列问题:
I.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4溶液、K3[Fe(CN)6]溶液
操作 | 现象 | 结论与解释 |
(1)取少量草酸亚铁晶体于试管中,加入2mL水,振荡后静置 | 有淡黄色沉淀,上层清液无色 | 草酸亚铁不溶于水 |
(2)继续加入2mL稀硫酸,振荡 | ___________ | 草酸亚铁溶于硫酸,硫酸酸性强于草酸 |
(3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | ___________ |
(4)①___________ | ②___________ | H2C2O4或C2O42-具有还原性 |
Ⅱ.定量探究:滴定实验测x的值
(5)滴定前,下列操作的正确顺序是___________(填字母序号)。
a.用0.1000mol/L的酸性KMnO4溶液润洗
b.查漏、清洗
c.排尽滴定管尖嘴的气泡并调整液面
d.盛装0.1000mol/L的酸性KMnO4溶液
e.初始读数、记录为0.50mL
(6)称取ng样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4溶液直接滴定,如何判断滴定终点?_______________。
(7)终点读数为20.50mL。结合上述实验数据求得x=___________(用含n的代数式表示,FeC2O4的相对分子质量为144)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
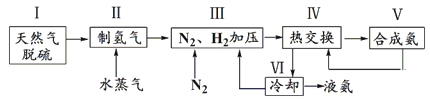
(1)①步骤Ⅱ中制氢气的原理如下:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g);K1
CO(g)+3H2(g);K1
b.CO(g)+H2O(g)![]() CO2(g)+H2(g);K2
CO2(g)+H2(g);K2
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g);K=_______________(用含K1、K2的代数式表示)。
CO2(g)+4H2(g);K=_______________(用含K1、K2的代数式表示)。
②T1温度时,对于反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
A.CO的转化率将增大 B.达到新平衡时的反应热ΔH > —Q
C.气体的密度将不变 D.H2O的体积分数增大
(2)将3 molH2和2 molN2充入某恒温恒压容器中,发生合成氨的反应:3H2(g) +N2(g) ![]() 2NH3(g)
2NH3(g)
①达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
A.6 molH2 + 4 molN2
B.0.75 molH2 + 0.75 molN2 + 0.5 molNH3
C.3 molH2+ 1 molN2 + 2 mol NH3
② 若是在恒温恒容的容器中反应,达到平衡时NH3的浓度为c1 mol·L-1,则c________c1(填“<”“>”或“=”),原因是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com