
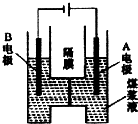
 �ö��Ե缫���ú��Һ�ķ�����H2�ķ�ӦΪC��s��+2H2O��l��=CO2��g��+2H2��g�����ֽ�һ������1mol/LH2SO4��Һ������ú�۳�ֻ�ϣ��Ƴɺ�̼��Ϊ0.02g/mL��0.12g/mL��ú��Һ��������ͼ��ʾװ���н��е�⣨���缫��Ϊ���Ե缫��������˵��������ǣ�������
�ö��Ե缫���ú��Һ�ķ�����H2�ķ�ӦΪC��s��+2H2O��l��=CO2��g��+2H2��g�����ֽ�һ������1mol/LH2SO4��Һ������ú�۳�ֻ�ϣ��Ƴɺ�̼��Ϊ0.02g/mL��0.12g/mL��ú��Һ��������ͼ��ʾװ���н��е�⣨���缫��Ϊ���Ե缫��������˵��������ǣ�������| A�� | A����������B��Ϊ���� | |
| B�� | A���ĵ缫��ӦʽΪC+2H2O-4e-=CO2��+4H+ | |
| C�� | B���ĵ缫��ӦʽΪ2H++2e-=H2�� | |
| D�� | ���һ��ʱ���ú��Һ��pH���� |
���� ����ͼ��֪AΪ��������Ϸ�Ӧ�Ļ�ѧ����ʽ��֪��̼ʧ���ӷ���������Ӧ���ɶ�����̼���������Ϸ������ǵõ��ӵĻ�ԭ��Ӧ2H++2e-=H2�������ݵ��صĹ���ԭ�����ش�
��� �⣺A���ö��Ե缫���ú��Һ�ķ�����H2�ķ�ӦΪ��C��s��+2H2O��l��=CO2��g��+2H2��g�������ݵ���װ�ã�A�缫Ϊ���ص�������B����������A��ȷ��
B��A�缫Ϊ���ص��������缫��ӦΪ��C+2H2O-4e-=CO2��+4H+����B��ȷ��
C��B�������������õ��ӵĻ�ԭ��Ӧ����2H++2e-=H2������C��ȷ��
D�����ݷ�Ӧ��C��s��+2H2O��l��=CO2��g��+2H2��g�������һ��ʱ���ˮ����С����������Ũ������pH��С����D����
��ѡD��
���� ���⿼�����Ȼ�ѧ����ʽ�����˹���ɵ�Ӧ�ã���ѧƽ�⣬��Ӧ���ʼ��㣬���ص缫��Ӧ�ķ����жϣ����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 40% | B�� | 33.3% | C�� | 60% | D�� | 36% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
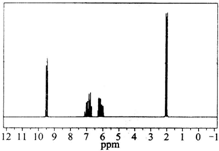 ����ͼ����ij�л������Է�������Ϊ70��������ױ�����C�TC��C�TO�Ĵ��ڣ�1H�˴Ź�������ͼ�������֮������Ϊ1��1��1��3����
����ͼ����ij�л������Է�������Ϊ70��������ױ�����C�TC��C�TO�Ĵ��ڣ�1H�˴Ź�������ͼ�������֮������Ϊ1��1��1��3�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ��ѧ�� | C-H | C-C | C=C | H-H |
| ����/kJ•mol��1 | 412 | 348 | 612 | 436 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | �Ҵ� | C�� | ����ϩ | D�� | ��ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com