
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.52 |
| 2 | 20.00 | 1.20 | 21.18 |
| 3 | 20.00 | 0.80 | 24.20 |
分析 (1)第三次实验有误差,HCl溶液体积比第一次和第二次大太多,舍去,然后求出另外两组的平均值,最后根据关系式HCl~NaOH来计算出NaOH的浓度;
(2)根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$来判断不当操作对相关物理量的影响.
解答 解:(1)第三次实验有误差,HCl溶液体积比第一次和第二次大太多,舍去,另外两组的平均值为V(HCl)=$\frac{(20.52-0.50)+(21.18-1.20)}{2}$=20.00mL,
则c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$=$\frac{0.1000mol•{L}^{-1}×0.020L}{0.020L}$=0.10mol•L-1,
故答案为:0.10;
(2)若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则消耗的标准溶液的体积偏大,由c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$可知,测定结果将偏高;
若读数时,滴定前仰视,滴定后俯视,则消耗的标准溶液的体积偏小,由c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$可知,测定结果将偏低;
故答案为:偏大,偏低.
点评 本题主要考查了滴定操作及误差分析,题目难度不大,侧重于考查学生的实验操作能力和数据处理能力.


科目:高中化学 来源: 题型:选择题

| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和③ | |
| C. | 发生水解反应时,被破坏的键是③ | |
| D. | 发生消去反应时,被破坏的键是①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
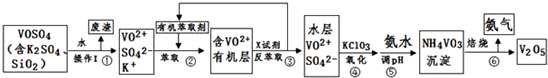
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式相同而结构式不同的化合物互称同分异构体 | |
| B. | 组成元素相同而结构式不同的物质互称同分异构体 | |
| C. | 互为同分异构体的物质性质相同 | |
| D. | 互为同分异构体的物质性质相异 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 | |
| B. | 使用高效催化剂可有效提高正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 升高温度可使该反应的逆反应速率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
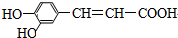
| A. | 只有②④⑤⑥ | B. | 只有①③④⑥ | C. | 只有①②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B)=0.075mol/(L•s) | B. | v(A)=0.030mol/(L•s) | C. | v(C)=0.040mol/(L•s) | D. | v(D)=0.060mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com