
分析 (1)单线桥中由失去电子的元素指向得电子的元素,反应中转移电子数为2e-;
(2)根据n=$\frac{m}{M}$计算HCl物质的量,根据方程式计算消耗MnO2的物质的量、生成氯气物质的量,再根据V=nVm计算生成氯气体积.
解答 (1)单线桥中由失去电子的元素指向得电子的元素,反应中转移电子数为2e-,标出反应中电子转移方向和数目为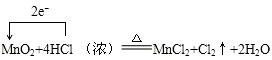 ,
,
故答案为: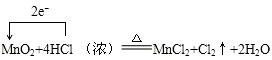 ;
;
(2)n(HCl)=$\frac{73g}{36.5g/mol}$=2mol,
MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 4mol 1mol
x 2mol y
x=y=$\frac{1mol×2mol}{4mol}$=0.5mol,
故V(Cl2)=0.5mol×22.4L/mol=11.2L,
答:当有73.0克HCl完全参加反时,消耗MnO2的物质的量为0.5mol,生成的气体在标准状况下的体积11.2升.
点评 本题考查氧化还原反应与化学方程式计算,比较基础,注意单线桥与双线桥表示电子转移.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的NaHSO4溶液 | B. | 0.04 mol•L-1 硫酸 | ||
| C. | 0.5 mol•L-1 盐酸 | D. | 0.05 mol•L-1硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ | B. | CO32- | C. | Na+ | D. | HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为气态,Z为固态 | B. | X为固态,Z为气态 | C. | X为气态,Z为气态 | D. | X为固态,Z为固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,冷凝水的方向应当由下往上 | |
| B. | 分液操作时,首先要打开分液漏斗的上口活塞,然后进行分液 | |
| C. | 提取碘水中的碘单质时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 萃取分液后,要得到被萃取的物质,通常还要进行蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ② | C. | ①②⑤ | D. | 全部反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com