
【题目】A、B、C、D是中学化学中常见的物质,已知C 为红棕色气体,它们之间的相互转化关系如下(部分反应条件及产物已略去)。

(1)若A为单质,则A的化学式为_________,试写出C→D反应的化学方程式:_________。
(2)A亦可为NH3,它与O2 在高温、催化剂的作用下反应生成B,此化学方程式为_________。
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.需要加热的化学反应都是吸热反应
B.原电池是将电能转化为化学能的一种装置
C.物质的燃烧都是放热反应
D.化学键的形成需吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进 行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能.下列有 关叙述正确的是( ) 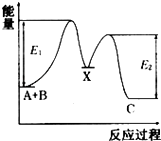
A.E2表示反应X→C的活化能
B.X是反应A十B→C的催化剂
C.反应A十B→C的△H<0
D.加入催化剂可改变反应A十B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体NH4I在密闭容器中受热分解发生下列反应:NH4I(s)NH3(g)+HI(g);2HI(g)H2(g)+I2(g)达到平衡时,c(HI)=4mol/L,c(I2)=0.5mol/L,下列说法正确的是( )
A.平衡时HI的分解率20%
B.反应起始时固体NH4I是5 mol
C.平衡时,c (NH3)=4.5mol/L
D.平衡时HI的分解率10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学方程式解释下列问题:
(1)实验室不用石英坩埚熔化NaOH固体: _________。
(2)漂白粉露置于空气中较长时间后失效: _________。
(3)Fe(OH)2暴露在空气中最后变成红褐色固体: _________。
(4)等物质的量的SO2与Cl2同时通入水中,溶液无漂白性:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)设起始 ![]() =Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( ) 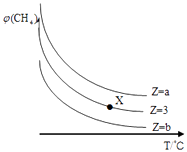
A.该反应的焓变△H>0
B.图中Z的大小为b>3>a
C.图中X点对应的平衡混合物中 ![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在.
(1)处理生活污水中的NH4+ , 过程如图1: 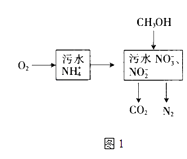
①根据较新的研究表明,将只含NO2﹣的污水与含NH4+的污水按比例混合,直接转化为无毒气体,该气体为 .
②空气将NH4+转变为NO3﹣或NO2﹣ , 溶液pH(填“增大”、“减小”或“不变”).
③完全处理含1mol NH4+污水,则n(O2)与n(CH3OH)关系式为[用n(O2)与n(CH3OH)表示].
(2)用焦炭还原NO2的反应为:2NO2(g)+2C(s )N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图2所示: 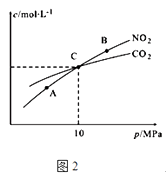
①A、B两点的浓度平衡常数关系:Kc(A)Kc(B) (填“>”、“<”或“﹦”).
②A、B、C三点中NO2的转化率最高的是(填“A”或“B”或“C”)点.
③计算C点时该反应的压强平衡常数Kp(C)=(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下: 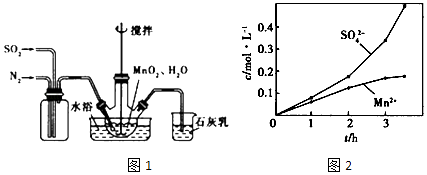
(1)制备MnSO4溶液:在烧瓶中(装置图1)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2 , 继续反应片刻,过滤
①写出反应方程式:MnO2+H2SO3=;石灰乳参与反应的化学方程式为 .
②反应过程中,为使SO2尽可能转化完全,在通人SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有(填两种)、 .
③若实验中将N2换成空气,测得反应液中Mn2+、SO42﹣的浓度随反应时间t变化如图2.导致溶液中Mn2+、SO42﹣浓度变化产生明显差异,若其中Mn2+对O2与H2SO3反应所起的作用是 .
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7.
请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2O,Ca(OH)2、NaHCO3、Na2CO3、C2H5OH].
①边搅拌边加入 , 并控制溶液pH7.7;
②;
③;
④;
⑤低于100℃干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A.电解时以精铜作阳极
B.电解时阴极发生氧化反应
C.粗铜连接电源负极,其电极反应是Cu=Cu2++2e﹣
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com