
·ÖĪö øł¾Żn=$\frac{m}{M}$¼ĘĖćKMnO4µÄĪļÖŹµÄĮ棬øł¾Ż·½³ĢŹ½¼ĘĖćĻūŗÄHClµÄĪļÖŹµÄĮæ”¢Éś³ÉĀČĘųµÄĪļÖŹµÄĮ森
£Ø1£©øł¾Żm=nM¼ĘĖćĻūŗÄHClµÄÖŹĮ棬±»Ńõ»ÆµÄHClÉś³ÉĀČĘų£¬øł¾ŻĀČŌ×ÓŹŲŗć¼ĘĖć±»Ńõ»ÆHClµÄÖŹĮ棻
£Ø2£©øł¾Żm=nM¼ĘĖćÉś³ÉĀČĘųÖŹĮ棬øł¾ŻV=$\frac{m}{¦Ń}$¼ĘĖćĀČĘųµÄĢå»ż£®
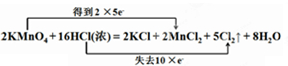
½ā“š ½ā£ŗn£ØKMnO4£©=$\frac{15.8g}{158g/mol}$=0.1mol£¬
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2ӟ+8H2O
2mol 16mol 5mol
0.1mol n£ØHCl£© n£ØCl2£©
Ōņn£ØHCl£©=$\frac{0.1mol”Į16mol}{2mol}$=0.8mol£¬n£ØCl2£©=$\frac{0.1mol”Į5mol}{2mol}$=0.25mol£¬
£Ø1£©²Ī¼Ó·“Ó¦HClÖŹĮæĪŖ£ŗm£ØHCl£©=0.8mol”Į36.5g/mol=29.2g£¬
±»Ńõ»ÆµÄHClÉś³ÉĀČĘų£¬øł¾ŻĀČŌ×ÓŹŲŗć£¬n£ØHCl£©±»Ńõ»Æ=2n£ØCl2£©=0.5mol£¬Ōņ m£ØHCl£©±»Ńõ»Æ=0.5mol”Į36.5g/mol=18.25g£¬
“š£ŗ15.8g KMnO4ÄÜŹ¹29.2gHCl·¢Éś·“Ó¦£»ÓŠ18.25gHCl±»Ńõ»Æ£»
£Ø2£©m£ØCl2£©=0.25mol”Į71g/mol=17.75g£¬¹ŹV£ØCl2£©=$\frac{m}{¦Ń}$=$\frac{17.75g}{3.17g/L}$”Ö5.6L£¬
“š£ŗ²śÉśµÄCl2ŌŚ±ź×¼×“æöĻĀµÄĢå»żŹĒ5.6L£®
µćĘĄ ±¾Ģāæ¼²é»Æѧ·½³ĢŹ½µÄ¼ĘĖć”¢Ńõ»Æ»¹Ō·“Ó¦¼ĘĖć£¬×¢Ņā“ÓŌŖĖŲ»ÆŗĻ¼Ū±ä»ÆĄķ½āŃõ»Æ»¹Ō·“Ó¦»ł±¾øÅÄī£¬ŹģĮ·ÕĘĪÕĪļÖŹµÄĮæÓŠ¹Ų¼ĘĖć£®


 æŖŠÄæģĄÖ¼ŁĘŚ×÷ŅµŹī¼Ł×÷ŅµĪ÷°²³ö°ęÉēĻµĮŠ“š°ø
æŖŠÄæģĄÖ¼ŁĘŚ×÷ŅµŹī¼Ł×÷ŅµĪ÷°²³ö°ęÉēĻµĮŠ“š°ø ĆūĢāѵĮ·ĻµĮŠ“š°ø
ĆūĢāѵĮ·ĻµĮŠ“š°ø ĘŚÄ©¼Æ½įŗÅĻµĮŠ“š°ø
ĘŚÄ©¼Æ½įŗÅĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
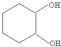 £¬Ęä¹ż³ĢČēĻĀ£ŗ
£¬Ęä¹ż³ĢČēĻĀ£ŗ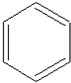 $”ś_{FeBr_{3}}^{Br_{2}}$A$”ś_{Ni”÷}^{H_{2}}$”śC”śD”ś
$”ś_{FeBr_{3}}^{Br_{2}}$A$”ś_{Ni”÷}^{H_{2}}$”śC”śD”ś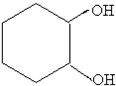
 £»
£»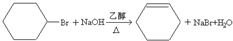 £»
£» £»
£» £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1 L 0.1 mol•L-1µÄŅŅ“¼ČÜŅŗÖŠ·Ö×Ó×ÜŹżĪŖ0.1NA | |
| B£® | ³£ĪĀ³£Ń¹ĻĀ£¬28 gŅŅĻ©ŗ¬ÓŠµÄµē×ÓŹżĪŖ16NA | |
| C£® | 44gŅŅĖįŅŅõ„ŗĶ¶”ĖįµÄ»ģŗĻĪļÖŠ¹²ŗ¬ÓŠĢ¼Ō×ÓŹżĪŖ2 NA | |
| D£® | m g±ūĻ©ŗĶĪģĻ©µÄ»ģŗĻĪļÖŠ¹²ÓƵē×Ó¶ŌŹżĪŖ$\frac{3m}{14}$NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4 L H2Oŗ¬ÓŠ·Ö×ÓŹżĪŖNA | |
| B£® | ·Ö×Ó×ÜŹżĪŖNAµÄN2”¢CO»ģŗĻĘųĢåĢå»żŌ¼ĪŖ22.4 L£¬ÖŹĮæĪŖ28 g | |
| C£® | ³£ĪĀ³£Ń¹ĻĀ£¬1.6 g CH4ŗ¬Ō×ÓŹżĪŖ0.5NA | |
| D£® | 4 g½šŹōøʱä³ÉøĘĄė×ÓŹ±Ź§Č„µÄµē×ÓŹżÄæĪŖ0.1 NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
 Ä³Ń§ÉśÓĆ0.100mol•L-1µÄKOH±ź×¼ČÜŅŗµĪ¶ØĪ“ÖŖÅØ¶ČµÄŃĪĖį£¬Ęä²Ł×÷æÉ·Ö½āĪŖČēĻĀ¼ø²½£ŗ
Ä³Ń§ÉśÓĆ0.100mol•L-1µÄKOH±ź×¼ČÜŅŗµĪ¶ØĪ“ÖŖÅØ¶ČµÄŃĪĖį£¬Ęä²Ł×÷æÉ·Ö½āĪŖČēĻĀ¼ø²½£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £»
£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| ĪĀ¶Č/”ę | 400 | 500 | 600 |
| SO2×Ŗ»ÆĀŹ/% | 99.2 | 93.5 | 73.7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
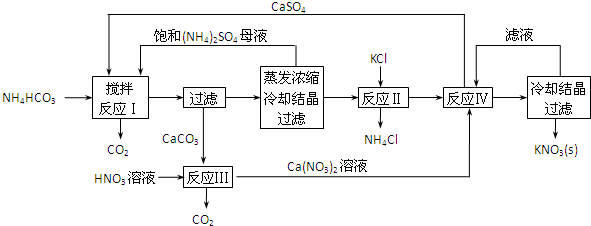
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com