
| A. | 1:8 | B. | 1:6 | C. | 1:5 | D. | 1:10 |
分析 Cu2S与一定浓度的HNO3反应中,Cu2S中铜元素由+1价被氧化为+2价、硫元素由-2价被氧化为+6价,硝酸起氧化剂与酸的作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2.令NO2和NO的物质的量分别为2mol、1mol,根据电子转移守恒计算参加反应的Cu2S的物质的量,由氮元素守恒可知参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO),根据铜元素守恒可知溶液中n[Cu(NO3)2]=2n(Cu2S)-n(CuSO4),由硫元素守恒可知n(Cu2S)=n(CuSO4),据此计算参加反应的硝酸的物质的量.
解答 解:Cu2S与一定浓度的HNO3反应中,Cu2S中铜元素由+1价被氧化为+2价、硫元素由-2价被氧化为+6价,硝酸起氧化剂与酸的作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2.
令NO2和NO的物质的量分别为2mol、1mol,根据电子转移守恒可知:
n(Cu2S)×[6-(-2)+1×2]=2mol×(5-4)+1mol×(5-2),解得n(Cu2S)=0.5mol.
由硫元素守恒可知n(CuSO4)=n(Cu2S)=0.5mol,
根据铜元素守恒可知溶液中n[Cu(NO3)2]=2n(Cu2S)-n(CuSO4)=2×0.5mol-0.5mol=0.5mol,
由氮元素守恒可知参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO)=2×0.5mol+2mol+1mol=4mol,
所以实际参加反应的Cu2S与HNO3的物质的量之比为n(Cu2S):n(HNO3)=0.5mol:4mol=1:8,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 提倡人们购物时减少使用塑料袋,是为了减少白色污染 | |
| B. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应进行集中填埋处理 | |
| D. | 硫氧化物和氮氧化物是形成酸雨的主要物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W四种元素的最外层电子数之和为18 | |
| B. | 原子半径由大到小的顺序:W>Z>Y>X | |
| C. | 单质的熔点:W>Z | |
| D. | 简单气态氢化物的稳定性:X>Y>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| B. | 氧氧化铁溶胶、含塑化剂的白酒、含有细菌的矿泉水均具有丁达尔效应 | |
| C. | 对“地沟油”蒸馏可以获得汽油 | |
| D. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
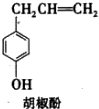 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:| A. | ①③ | B. | ①②④ | C. | ③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质都是离子化合物,因此NaCl是离子化合物 | |
| B. | 亚硫酸溶液的导电能力可能比稀硫酸强 | |
| C. | SO3溶于水,其水溶液能导电,SO3是电解质 | |
| D. | 石墨是单质,能导电,因此石墨是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 | |
| B. | 实验结束后,用嘴吹灭酒精灯 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 金属钠着火,立即用水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com